
分析 某待测液中可能含有大量Mg2+、Cu2+、Fe3+、K+、H+、NO3-、OH-离子中的一种或几种,
(1)取少量待测液,仔细观察,呈无色,则不含有色离子Cu2+、Fe3+且溶液中没有沉淀生成;
(2)向上述待测液中滴加NaOH溶液,先无明显现象,后有白色沉淀生成,说明溶液中含有H+、Mg2+,则溶液中一定不含OH-,
(3)向上述溶液中加入BaCl2溶液,无现象,没有沉淀生成,说明不含SO42-;
溶液呈电中性,所以一定含有NO3-;
通过以上分析知,无法确定溶液中是否含有K+,
解答 解:某待测液中可能含有大量Mg2+、Cu2+、Fe3+、K+、H+、NO3-、OH-离子中的一种或几种,
(1)取少量待测液,仔细观察,呈无色,则不含有色离子Cu2+、Fe3+且溶液中没有沉淀生成;
(2)向上述待测液中滴加NaOH溶液,先无明显现象,后有白色沉淀生成,说明溶液中含有H+、Mg2+,则溶液中一定不含OH-,
(3)向上述溶液中加入BaCl2溶液,无现象,没有沉淀生成,说明不含SO42-;
溶液呈电中性,所以一定含有NO3-;
通过以上分析知,溶液中一定含有H+、Mg2+、NO3-,一定不含Cu2+、Fe3+、OH-、SO42-、可能含有 K+
,要检验是否含有钾离子,需要做焰色反应,
(2)中加入氢氧化钠后有氢离子、镁离子和氢氧根离子的反应,所以离子反应方程式分别为H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓,
故答案为:H+、Mg2+、NO3-; Cu2+、Fe3+、OH-、SO42-;K+;H++OH-=H2O;Mg2++2OH-=Mg(OH)2↓.
点评 本题考查离子检验,为高频考点,明确离子颜色、离子性质、离子共存条件等知识点是解本题关键,知道常见离子检验方法及其现象,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | B>C>A>D | B. | A>C>D>B | C. | D>A>C>B | D. | C>D>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入少许KCl固体,溶液颜色变浅 | |
| B. | 升高温度,平衡一定发生移动 | |
| C. | 加入少许KCl固体或者加入少许FeCl3固体平衡常数均发生变化,且变化方向相反 | |
| D. | 平衡常数表达式为K=$\frac{c[Fe(SCN)_{3}]•{c}^{3}(KCl)}{c(FeC{l}_{3})•{c}^{3}(KSCN)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
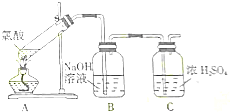
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+):②>④>③>① | B. | pH:②>③>④>① | ||
| C. | c(H+):①>③>②>④ | D. | c(NH3•H2O):②>④>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
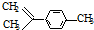 ,有关分析正确的是( )
,有关分析正确的是( )| A. | 一氯代物共有7种 | B. | 分子中所有碳原子一定在同一平面 | ||
| C. | 和 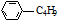 互为同分异构体 互为同分异构体 | D. | 1mol柠檬烯与H2反应最多消耗4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
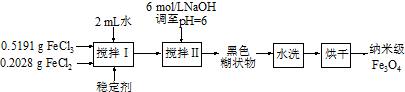
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com