
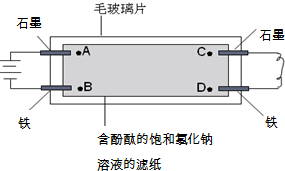
 如图所示,在毛玻璃片上放有一张浸有含酚酞的饱和氯化钠溶液的滤纸,滤纸上点有A、B、C、D四个点(指靠近电极的溶液).有关说法正确的是 ( )
如图所示,在毛玻璃片上放有一张浸有含酚酞的饱和氯化钠溶液的滤纸,滤纸上点有A、B、C、D四个点(指靠近电极的溶液).有关说法正确的是 ( )| A、A点比B点先出现红色 |
| B、B点比A点先出现红色 |
| C、A点比C点先出现红色 |
| D、D点比C点先出现红色 |


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
| A、有气体参加的化学反应,若增大压强,可增加活化分子的百分数,从而使反应速率增大 |
| B、催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率 |
| C、增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多 |
| D、升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
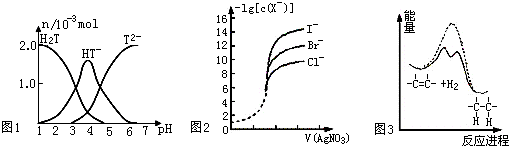
| A、常温下,向20mL0.1mol?L-1酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图1,则当VNaOH=10mL时,溶液中存在2C(Na+)=C(H2T)+C(HT-)+C(T2-) | ||
| B、用0.0100mol?L-1硝酸银标准溶液,滴定浓度均为0.100mol?L-1的 Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | ||
C、已知25℃、101kPa时:①2Na(s)+
| ||
| D、由图3可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
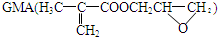 用作印刷油墨的黏合剂,可由如图路线合成(部分反应条件和产物略去):
用作印刷油墨的黏合剂,可由如图路线合成(部分反应条件和产物略去):
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
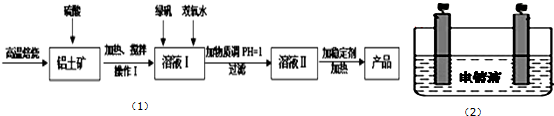
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com