
 (1)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,则由氢气和碘反应生成1mol HI的反应热 为-1.5kJ/mol
(1)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,则由氢气和碘反应生成1mol HI的反应热 为-1.5kJ/mol分析 (1)依据反应焓变△H=反应物总键能-生成物的总键能分析判断;
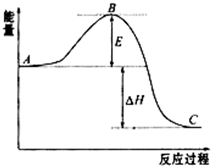
(2)①A、C、E分别表示反应物总能量、生成物总能量、正反应反应活化能;
②参加反应SO2的物质的量之比等于对应的△H之比;
③反应方程式中化学计量数之比等于速率之比;
(3)待求反应中反应物C在①中是反应物,反应物H2O在②中是生成物,生成物CO在③中是反应物,①应减去②③,运用盖斯定律解答,注意热化学方程式加减时,对应的△H也要同时进行加减.
解答 解:(1)已知拆开1mol H-H键、1mol I-I键、1mol H-I键分别需要吸收的能量为436kJ、151kJ、295kJ,I2+H2=2HI,则由氢气和碘反应生成2mol HI;
反应的焓变=436kJ+151kJ-2×295kJ=-3KJ,所以生成1mol HI的反应热 为-1.5kJ/mol;
故答案为:-1.5;
(2)①图中A、C、E分别表示反应物总能量、生成物总能量、正反应反应活化能;
故答案为:生成物总能量;正反应活化能;
②1mol SO2(g)氧化为1mol SO3的△H=-100kJ•mol-1,所以2mol SO2(g)氧化为2mol SO3的△H=-200kJ•mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-200kJ•mol-1,
故答案为:-200;
③反应方程式中化学计量数之比等于速率之比,v(SO2)为0.02mol•L-1•min-1,则v(O2)=$\frac{1}{2}$×0.02mol•L-1•min-1=0.01mol•L-1•min-1;
故答案为:0.01mol•L-1•min-1;
(3)①C(s)+O2(g)═CO2(g)△H=-538.3kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律计算,①-②-③得到固态碳与水蒸汽反应生成一氧化碳和氢气的热化学方程式是:C(s)+H2O(g)=CO2(g)+H2(g)△H=-30.5kJ•mol-1;
故答案为:C(s)+H2O(g)=CO2(g)+H2(g)△H=-30.5kJ•mol-1.
点评 本题考查反应过程的能量变化图、运用盖斯定律进行反应热的计算、反应速率的计算等,题目难度中等,注意把握盖斯定律在反应热计算中的应用方法,侧重于考查学生的分析能力和计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 实验室制氨气:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | AlCl3溶液中滴加足量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑥ | C. | ②③⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | NaCl | C. | NH3•H2O | D. | NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:乙烷>甲烷 | |
| B. | 二氯甲烷有两种不同结构的同分异构体 | |
| C. | C2H4与C4H8一定是同系物 | |
| D. | 甲苯的一氯代物有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,结构式是F-O-O-O-F.
,结构式是F-O-O-O-F.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
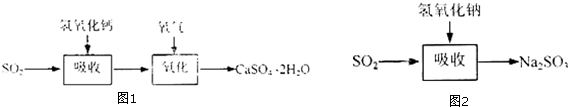
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,硫酸溶液的导电能力应强于醋酸溶液的导电能力 | |
| B. | NaCl在电流作用下电离成Na+和Cl- | |
| C. | CuSO4溶液导电时要伴随化学变化 | |
| D. | CO2水溶液的导电能力较弱,CO2是弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com