
| A. | 液氨气化 | B. | 酸城中和 | C. | 浓硫酸加水稀释 | D. | 镁条与盐酸反应 |
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸混合:2H++CO32-═CO2↑+H2O | |
| B. | Al投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ | |
| C. | 亚硫酸钠溶液与稀硫酸混合:2H++SO32-═SO2↑+H2O | |
| D. | 二氧化锰与浓盐酸混合后加热:MnO2+4H++4Cl-═MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
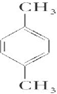 ;
;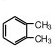 ;
;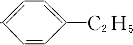 、
、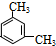 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等.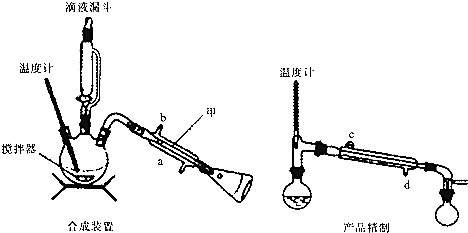
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
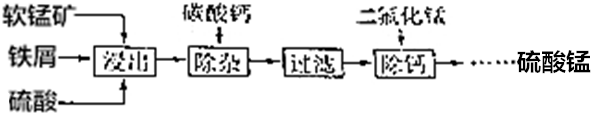
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:Na+、K+、SO${\;}_{4}^{2-}$、AlO${\;}_{2}^{-}$ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-12mol•L-1的澄清溶液中:Cu2+、Mg2+、SO42-、NO${\;}_{3}^{-}$ | |
| C. | 0.1mol•L-1FeCl2溶液中:Al+、Ca2+、SCN-、ClO- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
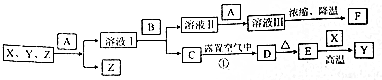
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 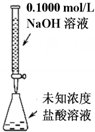 可以进行酸碱中和滴定实验 | |
| B. | 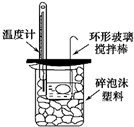 可以进行中和热的测定实验 | |
| C. | 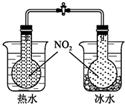 可验证温度对化学平衡的影响 | |
| D. | 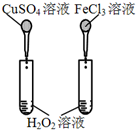 比较Cu2+、Fe3+对H2O2分解速率的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com