

分析 (1)组成氧硫化碳和磷化氢的原子为O、S、P、H,先判断电子层数,电子层数越多,原子半径越大;电子层数相同,再根据元素周期律,同周期元素的原子半径随着原子序数的增大而减小;
(2)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱;
(3)①依据热化学方程式书写方法,标注物质的聚集状态和对应反应的焓变写出热化学方程式;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,依据电荷守恒和原子守恒书写离子反应方程式.
解答 解:(1)组成氧硫化碳和磷化氢的原子为O、S、P、H,氢元素有1个电子层,氧元素有2个电子层,磷、硫有3个电子层,所以磷、硫的原子半径大于氢、氧的原子半径,磷、硫是同周期元素,硫的原子序数大于磷的原子序数,由元素周期律知,磷的原子半径大于硫的原子半径;
故答案为:P;
(2)比较两种元素的非金属性强弱,可根据单质之间的置换反应、与氢气反应的难易程度、氢化物的稳定性以及最高正价氧化物对应水化物酸性强弱等角度,而最高正化合价、氢化物的沸点高低不能用于比较元素的非金属性强弱,
故答案为:b;
(3)①反应Ⅱ为硫化氢和氢氧化钠的反应H2S+2NaOH=Na2S+H2O,1.7g H2S的物质的量为n=$\frac{m}{M}$=$\frac{1.7g}{34g/mol}$=0.05mol,反应放出热量4.76kJ,则1mol硫化氢反应放出95.2KJ的热量,所以该反应的热化学方程式为H2S(g)+2NaOH(aq)=Na2S(aq)+H2O(l)△H=-95.2kJ/mol,
故答案为:H2S(g)+2NaOH(aq)=Na2S(aq)+H2O(l)△H=-95.2kJ/mol;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有阴离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,
故答案为:2S2-+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-.
点评 本题考查了原子半径大小的比较、非金属性强弱比较、热反应方程式的书写、离子反应方程式的书写等,注意电子层结构相同的离子半径大小的比较方法.注意元素非金属性和金属性的比较角度,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是以烃A为原料经过一系列反应合成的:
)是以烃A为原料经过一系列反应合成的:

 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O.
+2NaCl+2H2O. +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种常见氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有最高正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
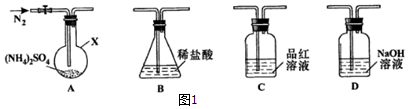
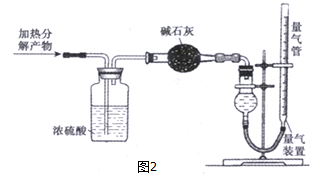
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含量最高的元素。下列说法正确的是( )
A. 原子半径的大小顺序:r(Y)> r(Z)>r(W)
B. 元素Z、W的简单离子的电子层结构相同
C. 元素Y 的简单气态氢化物的热稳定性比Z 的强
D. 只含X、Y、Z三种元素的化合物,一定是共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com