
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%。现取20 mL pH=3 的 CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为
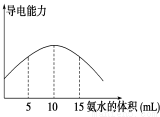
A.0.5% B.1.5% C.0.1% D.1%
科目:高中化学 来源:2015届浙江省慈溪市、余姚市高三上学期期中联考化学试卷(解析版) 题型:选择题
北京奥运会火炬使用的燃料是一种常用燃料,其分子式为C3H8,它属于
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
下列各组离子在对应溶液中可能大量存在的是
A.水电离出的c(H+)=10-12 mol·L-1的溶液:K+、Cu2+、SO32-、MnO4-
B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl-
C.含有大量ClO-的溶液:H+、I-、SO42-、Cl-
D.pH=12的溶液:K+、Cl-、SO32-、SiO32-
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
下列说法正确的是
A.海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t。由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素”
B.活泼金属元素的氧化物一定是碱性氧化物,非金属元素的氧化物一定是酸性氧化物
C.氢氧化铁溶胶、甘油与乙醇的混合液、含PM2.5的大气均具有丁达尔效应
D.绿色化学期望利用化学原理从源头消除污染,在化学过程中充分利用原料,实现零排放
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:填空题
(每空2分,共12分)
PCl3与PCl5均是有机合成的重要中间体,两者存在以下相互转化关系:
PCl5(g)  PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
PCl3(g) + Cl2(g) △H=a kJ·mol-1 在210℃时,将4mol PCl5气体充入
2L真空密闭容器中发生上述反应,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 |
n(PCl5) | 4 | 2.8 | 2 | 2 |
(1)已知上述反应在温度较高时才能自发进行,则a 0(填﹥、﹦、﹤);
(2)计算从20s至40s共20s的时间内,用PCl3表示的平均反应速率为 。210℃时该反应的平衡常数K值等于 。
(3)反应进行至60s后,将混合物的温度降低,重新达到平衡后氯气浓度将 (填“增大”、“减少”或“不变”)。
(4)欲增大该反应的K值,可采取的措施有(填序号)
A.降低温度 B.向混合气体中通入Cl2
C.使用高效催化剂 D.升高温度
(5)如右图是210℃时容器中PCl5物质的量的变化曲线,请在该图中补画出该反应在160℃时PCl5物质的量的变化曲线。

查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
反应A(g)+B(g) C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变。
C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变。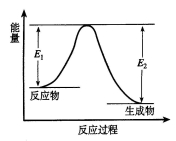
下列说法正确的是
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H<0,反应达到平衡时,升高温度,A的转化率增大
D.△H>0,反应达到平衡时,升高温度,A的转化率减少
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,17g羟基中含有的电子数目为10NA
B.常温常压下,28g由C2H4和C3H6组成的混合气体中含有的碳原子数目为2NA
C.0.05mol熔融的NaHSO4中含有的离子数目为0.15NA
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
根据“绿色化学”的思想,某化学家设计了下列化学反应步骤:
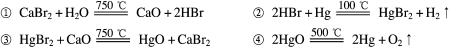
该方案的相关叙述正确的是
A.该实验的目的是制取HBr B.该过程的副产品是Hg
C.该过程得到的气体只有H2 D.该过程的本质是水的分解
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:选择题
向60 mL Na2SO4溶液中加入BaCl2溶液,有关数据见下表:
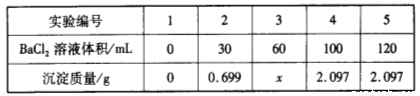
下列有关说法不正确的是( )
A.混合前,BaCl2溶液的物质的量浓度为0.10 mol·L-1
B.混合前,Na2SO4溶液的物质的量浓度为0.15 mol·L-1
C.3号实验中沉淀的质量x为1.398 g
D.完全沉淀60 mL Na2SO4溶液消耗BaCl2溶液的体积为80 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com