
【题目】吗啡和海洛因都是严格查禁的毒品,吗啡分子含C:71.58%、H:6.67%、N:4.91%、其余为O。已知其相对分子质量不超过300。试求:
(1)吗啡的相对分子质量__________;
(2)吗啡的化学式_______________;
已知海洛因是吗啡的二乙酸酯。试求:
(3)海洛因的相对分子质量____________;
(4)海洛因的化学式___________________.
【答案】285 C17H19NO3 369 C21H23NO5
【解析】
(1)吗啡分子中C、H、N、O的质量分数分别为71.58%、6.67%、4.91%和16.84%,其相对分子质量不超过300,计算吗啡分子中C、H、O原子数目确定其分子式;
(2)令海洛因的分子式为A,反应可以表示为:C17H19NO3+2CH3COOH→A+2H2O,利用质量守恒定律计算海洛因的相对分子质量、分子式。
(1)①吗啡分子中C、H、N、O的质量分数分别为71.58%、6.67%、4.91%和16.84%,其相对分子质量不超过300,分子中N原子最大数目![]() ,故吗啡分子中含有1个N原子,则吗啡的相对分子质量
,故吗啡分子中含有1个N原子,则吗啡的相对分子质量![]() ;
;
②吗啡分子中C原子数目![]() ,H原子数目
,H原子数目![]() ,O原子数目
,O原子数目![]() ,吗啡分子中含有1个N原子,故吗啡的分子式为C17H19NO3;
,吗啡分子中含有1个N原子,故吗啡的分子式为C17H19NO3;
故答案为:285;C17H19NO3;
(2)①海洛因是吗啡的二乙酸酯,令海洛因的分子式为A,反应可以表示为:![]() ,则海洛因的相对分子质量285+2×60-2×18=369;
,则海洛因的相对分子质量285+2×60-2×18=369;
②一分子吗啡和两分子乙酸反应脱去两分子水,所以其分子式![]() 。
。
故但为:369; C21H23NO5。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】有机物K是某药物的合成中间体,其合成路线如图所示:
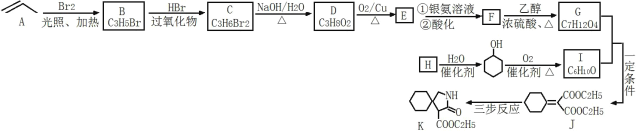
已知:HBr与不对称烯烃加成时,在过氧化物作用下,则卤原子连接到含氢较多的双键碳上;
请回答下列问题:
(1)C的化学名称为____,J中官能团的名称是____;
(2)H→![]() 的原子利用率为100%,则H的结构简式为____;
的原子利用率为100%,则H的结构简式为____;
(3)C→D的化学方程式为____;
(4)E与足量的Ag(NH3)2OH溶液反应的化学方程式为____;
(5)L是G的同分异构体,则满足下列条件的L的结构简式为____(任写一种结构即可)。
①lmol L与足量的NaHCO3溶液反应能生成2molCO2;
②L的核磁共振氢谱有3组峰且峰面积之比为1︰2︰3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯是一种难溶于水,密度大于水的无色油状液体,具有茉莉花气味,可用做调香剂。
(一)以乙烯,甲苯为原料,合成乙苯甲酯的路线如图所示。

(1)写出由乙烯制备A的化学方程式______。
(2)写出生成乙酸苯甲酯的化学方程式______。
(3)C到苯甲醇的反应类型______。
(二)制备乙酸苯甲酯的流程如图:
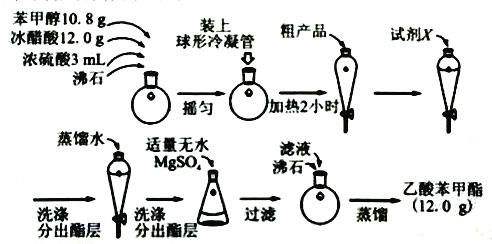
(4)球形冷凝管的作用为______。
(5)试剂X可为______。
A.氢氧化钠溶液 B.碳酸钠溶液 C.乙醇 D.氯化钠溶液
(6)分出酯层时应收集______层液体(填“上”或“下”)
(7)无水MgSO4的作用为______。
(8)本实验所得乙酸苯甲酯的产率为______。(已知:相对分子量:苯甲醇:108;乙酸:60;乙酸苯甲酯:150)。
查看答案和解析>>
科目:高中化学 来源: 题型:
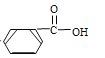
【题目】有机反应中,加氧或去氢的反应称之为氧化反应,反之则称为还原反应,下列反应中属于还原反应的是
A.CH3CHO ![]() CH3CH3OHB.CH3COOH
CH3CH3OHB.CH3COOH ![]() CH3COOC2H5
CH3COOC2H5
C.![]()
![]()
![]() D.
D.![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H为八种短周期主族元素,原子序数依次增大。A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、H在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17。D与F同周期。G的单质常用作半导体材料。请回答:
(1)C和H分别与A形成的简单化合物沸点较高的是________(填化学式),理由是_____________。
(2)C、E形成的简单离子半径大小:r(C)______r(E)(填>、<或=)
(3)请写出F最高价氧化物对应的水化物在水溶液中的电离方程式______________。
(4)B与G形成的化合物常用于做耐高温材料,工业可用碳热还原法制取:将G的氧化物与B的单质在1400℃条件下和足量的碳反应,请写出化学反应方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是( )
A.升高温度,该反应的平衡常数减小
B.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
C.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D.第二阶段,Ni(CO)4分解率较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是_______
A.将胆矾加热除去结晶水后,称取16g溶解在1L水中
B.称取25g胆矾溶于水,然后将此溶液稀释至1L
C.称取25g胆矾溶解在1L水里
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.1molAl分别与足量的稀硫酸和稀硝酸反应转移电子数均为3NA
B.0.1molN4S4(结构如图所示)含有NA个S—N键
C.标准状况下,1mol甲基(—14CD3)所含的中子数为10NA
D.1molCH3COOC2H5在稀硫酸中水解可得到的乙醇分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S 为二元弱酸,20 ℃的 pKa1=6.89,pKa2=14.15(电离常数 K 的负对数-lg K=pK)。在20 ℃时,向 0.1 mol·L1 的 Na2S 溶液中缓慢通入 HCl(忽略溶液体积变化和 H2S 的挥发),在该过程中下列微粒物质的量浓度关系一定正确的是
A.溶液中 c(HS-)=c(S2-)时,c(S2-)+2c(H2S)<c(Cl-)
B.溶液呈中性时,c(HS- )+c(H2S)=c(Cl- )
C.溶液 pH=6.89 时,c(Cl- )>c(HS- )=c(H2S)>c(H+)>c(OH-)
D.溶液中 c(Cl-)=0.2 mol·L-1 时,c(OH-)+c(HS- )+c(S2-)=c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com