
①
②中和
③0.005 mol 物质A完全转化为羧酸乙酯,需乙醇
试求:
(1)物质A的摩尔质量、实验式和分子式。
(2)A的无水物的结构简式、实验式和俗名。
(1)A的摩尔质量为
(2)A的无水物为草酸,即乙二酸,结构简式为![]() ,实验式为CHO2。
,实验式为CHO2。
解析:题文②③两个条件的目的是求A属n元酸,可根据A与碱反应的物质的量比、A与乙醇酯化的物质的量比求知,比例为1∶n,即为n元酸。
本题并不复杂,主要是理解题文,依据每个条件求解。
(1)根据①求出晶体中C、H、O的原子数比:
m(C)=(![]() )×
)×
m(H)=![]() ×
×
m(O)=
则n(C)∶n(H)∶n(O)=![]() =1∶3∶3
=1∶3∶3
晶体的实验式为CH3O3。
(2)根据③求酸的元数(n),即1 mol酸最多与乙醇反应的物质的量数:
1∶n=0.005∶(0.46÷46)=1∶2,n=2
(3)根据②求酸A的相对分子质量。二元酸的物质的量应是NaOH的物质的量的一半,即有
![]() =0.002 mol,所以,A的摩尔质量为
=0.002 mol,所以,A的摩尔质量为![]() =
=
(4)求A分子式(CH3O3)x。合并(1)(3)求解结论,即有(CH3O3)x的相对分子质量为126,则x=![]() =2,则A分子式为C2H6O6。
=2,则A分子式为C2H6O6。
(5)根据题文隐含条件分析晶体和无水物的结构。
A是二元羧酸,无水物分子中仅含4个氧,另外两个氧原子为结晶水的氧,即含有两个结晶水。A为C2H2O4·2H2O(也可以用CnH2n-2O4分析,C2H6O6-C2H2O4=2H2O)。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:
某金属M的氢氧化物的结晶水合物M(OH)2·xH2O与Na2CO3的混合物共36.800 g,加入足量的水后,生成白色沉淀(沉淀不含结晶水),将沉淀滤出,洗净烘干,称得其质量为9.850 g。将得到的沉淀高温灼烧后,质量变为7.650 g;滤液与酸作用不产生气体;若用足量的铵盐与滤液共热,则产生4.48 L气体(标准状况)。求:
⑴滤液中OH-的物质的量为__________mol。
⑵若M的中子数为81,则M的元素符号为____________。
⑶M的氢氧化物的结晶水合物的化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某金属M的氢氧化物的结晶水合物M(OH)2·xH2O与Na2CO3的混合物共36.8g,加入足量的水后,生成白色沉淀(沉淀中不含结晶水),将沉淀过滤、洗涤、烘干,称得其质量为9.85g,将得到的沉淀高温灼烧后,质量变为7.65g,滤液与酸作用不产生气体,若用足量的铵盐与滤液共热,则产生4.48L气体(标准状况)。
(1)滤液中n(OH-)=____________mol
(2)M的相对原子质量_____________________
(3)M的氢氧化物的结晶水合物的化学式为____________________
(4)将M的此氢氧化物与NH4Cl置右图所示装置(玻璃片中与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,玻璃片将___________________,与该反应对应的能量变化关系图是_________
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市虹口区高三上学期期末考试(一模)化学试卷(解析版) 题型:计算题
胆矾晶体是硫酸铜的结晶水合物,其化学式为CuSO4•5H2O。在加热情况下,按温度不同,胆矾晶体会历经一系列的变化,得到不同组成的固体。
(1)称取0.1000 g含有杂质的胆矾试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L硫酸滴定到终点,消耗硫酸10.08 mL,则试样中胆矾的质量分数为___________。
(已知:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4;试样中的杂质不与酸、碱反应)
(2)将1.250 g 纯净的胆矾晶体置于坩埚中加热一段时间,测得剩余固体质量为0.960 g。剩余固体中结晶水的质量分数为__________(保留三位小数)。
(3)将无水硫酸铜加热至650℃以上,可得到黑色的氧化铜与三氧化硫、二氧化硫和氧气的混合气体。现将9.600 g无水硫酸铜充分加热分解为氧化铜,将生成的气体通过足量的吸收剂(碱石灰),吸收剂增重4.416 g。计算最终吸收剂中硫酸盐与亚硫酸盐的物质的量之比。
(4)无水硫酸铜受热分解成氧化铜之前,有一种黄色中间产物X出现,其化学式可以表示为CuaOb(SO4)c(a、b、c为整数)。将X放入水中,有不溶的蓝色沉淀Y生成(化学式为CuSO4·nCu(OH)2),同时还有2/3的硫酸根溶于水。若对Y进行加热脱水,将失去11.9%的质量。已知X和Y均可溶于稀硫酸。通过计算确定X和Y的化学式。
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高一上学期质量检测化学试卷 题型:计算题
某金属M的氢氧化物的结晶水合物M(OH)2·xH2O与Na2CO3的混合物共36.8g,加入足量的水后,生成白色沉淀(沉淀中不含结晶水),将沉淀过滤、洗涤、烘干,称得其质量为9.85g,将得到的沉淀高温灼烧后,质量变为7.65g,滤液与酸作用不产生气体,若用足量的铵盐与滤液共热,则产生4.48L气体(标准状况)。
(1)滤液中n(OH-)=____________mol
(2)M的相对原子质量_____________________
(3)M的氢氧化物的结晶水合物的化学式为____________________
(4)将M的此氢氧化物与NH4Cl置右图所示装置(玻璃片中与烧杯底部之间有一薄层水)中混合反应后,用手拿起烧杯时,玻璃片将___________________,与该反应对应的能量变化关系图是_________
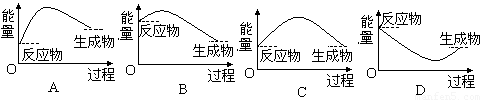
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com