
����Ŀ��ͼ�ס�����ʾװ�ý���ʵ�飬ͼ�������ձ������ҺΪͬŨ�ȵ�ϡ���ᣬ����GΪ�����ơ���ش���������
��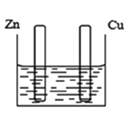 ��
��
(1)���������У���ȷ����______��
A.����пƬ�Ǹ���������ͭƬ������
B.���ձ���ͭƬ����������ݲ���
C.���ձ�����Һ��pH������
D.���е�����ͭƬ����������пƬ
E.����Һ��![]() ��ͭƬ�����ƶ�
��ͭƬ�����ƶ�
(2)�仯����������ת������ʽ��Ҫ�ǣ���Ϊ____����Ϊ_____��
(3)����Ӧ��������![]() ���ӷ���ת�ƣ������ɵ������ڱ���µ����Ϊ__________
���ӷ���ת�ƣ������ɵ������ڱ���µ����Ϊ__________
(4)ԭ����ڹ���ʱ�����з�Ӧ��������Ϊԭ��ع���ʱ�����ķ�Ӧ���ǣ�______
A.![]()
B.![]()
C.![]()
D.![]()
���𰸡�CD ��ѧ��ת��Ϊ���� ��ѧ��ת��Ϊ���� ![]() C
C
��������
(1)A.��û���γɱպϻ�·�������γ�ԭ��أ���A����
B.ͭ�ڽ������˳�����λ��HԪ��֮��Cu������ϡ���ᷴӦ�����ձ���ͭƬ����û�����ݲ�������B����
C.���ձ��е��ܷ�Ӧ��ΪZn+2H+=Zn2++H2����������Ũ�ȼ�С����Һ��pH������C��ȷ��
![]() ���γ�ԭ��أ�ZnΪ������CuΪ������ԭ��ص����ɸ��������·�����������������ͭƬ����������пƬ����D��ȷ��
���γ�ԭ��أ�ZnΪ������CuΪ������ԭ��ص����ɸ��������·�����������������ͭƬ����������пƬ����D��ȷ��
E.ԭ�������������������������������������Һ��![]() ��пƬ�����ƶ�����E����
��пƬ�����ƶ�����E����
�ʴ�Ϊ��CD��
(2)��û���γɱպϻ�·�������γ�ԭ��أ���Ӧ���ȣ�����ѧ��ת��Ϊ���ܣ����γɱպϻ�·���γ�ԭ��أ�����ѧ��ת��Ϊ���ܣ�
�ʴ�Ϊ����ѧ��ת��Ϊ���ܣ���ѧ��ת��Ϊ���ܣ�
(3)��Ӧ�Ĺ�ϵʽΪ![]() ����
����![]() ��
��![]() ��
��
�ʴ�Ϊ��![]() ��
��
(4)ԭ����з��������Է����еķ��ȵ�������ԭ��Ӧ��A��B��D��Ϊ�Է����еķ��ȵ�������ԭ��Ӧ�������γ�ԭ��أ�C�еķ�Ӧ![]() �Ǹ��ֽⷴӦ���Ƿ�������ԭ��Ӧ������C������Ϊԭ��ع���ʱ�����ķ�Ӧ��
�Ǹ��ֽⷴӦ���Ƿ�������ԭ��Ӧ������C������Ϊԭ��ع���ʱ�����ķ�Ӧ��
�ʴ�Ϊ��C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ϩ�ܷ�������ת����
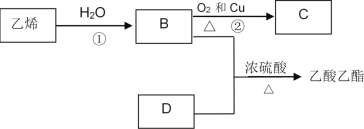
(1)��ϩ�Ľṹ��ʽΪ��______________
(2)д��B��D�������й��������ƣ�
B�������_____________��D�������_________��
(3)д����Ӧ�Ļ�ѧ����ʽ
��___________________________________________ ��Ӧ���ͣ�___________
��___________________________________________ ����Ӧ���ͣ�___________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���ԭ���ķ����Ǵ��ܺ��ܼ����ľ�������ǻ�ѧ�������һ���ش��ס�
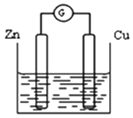
��1������пƬ�ʹ�ͭƬ��ͼ��ʽ����100 mL��ͬŨ�ȵ�ϡ������һ��ʱ�䣬�ش��������⣺

������˵����ȷ����__________��
A���ס��Ҿ�Ϊ��ѧ��ת��Ϊ���ܵ�װ�� B������ͭƬ��û�����Ա仯
C������ͭƬ�������١�����пƬ�������� D�����ձ�����Һ�� pH ������
������ͬʱ���ڣ� ���ձ��в������ݵ��ٶȣ� ��__________��(�>���� ��<������)��
����д��ͼ�й���ԭ��صĸ����缫��Ӧʽ�� ____________��
�ܵ�������Һ�������� 31.5 ��ʱ���缫��ת�Ƶ�����ĿΪ______��
��2��ͼ��Ϊ��������ȼ�ϵ�صĹ���ʾ��ͼ���������Һ�������� KOH��ͨ����һ���ĵ缫��Ӧ����ʽΪ ______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol/LCH3COOH��Һ�д������µ���ƽ�⣺CH3COOH![]() CH3COO����H+���ڸ�ƽ�⣬����������ȷ����( )
CH3COO����H+���ڸ�ƽ�⣬����������ȷ����( )
A. ����ˮʱ��ƽ�����淴Ӧ�����ƶ�
B. ��������NaOH���壬ƽ��������Ӧ�����ƶ�
C. ��������0.1mol��L��1 HCl��Һ����Һ��c(H+)��С
D. ��������CH3COONa���壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �����һ���ܱ���ˮ�����һ����������أ���ط�Ӧ����ʽΪ��
�����һ���ܱ���ˮ�����һ����������أ���ط�Ӧ����ʽΪ��![]() ���йظõ�ص�˵����ȷ����
���йظõ�ص�˵����ȷ����
A.�����ں���Ӧ����������B.MgΪ��ص�����
C.������ӦΪ![]() D.���ܱ�KCl��Һ����
D.���ܱ�KCl��Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MnSO4��H2O��һ��������ˮ����ɫб�����壬ijͬѧ�������װ���Ʊ������̣�
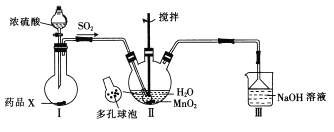
����˵���������
A. װ��I��ƿ�з����ҩƷXΪͭм
B. װ��II���������������������SO2����������
C. װ��III��������δ��Ӧ��SO2
D. ��װ��II��Ӧ�����Һ�Ʊ�MnSO4��H2O�辭�������ᾧ�����ˡ�ϴ�Ӽ�����Ĺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij100mL��Һ���ܺ���Na+��NH4+��Fe3+��CO32����SO42����Cl���е������֣�ȡ����Һ��������ʵ�飬ʵ�������ͼ���������Լ�������������ȫ���ݳ�������˵������ȷ���ǣ�������
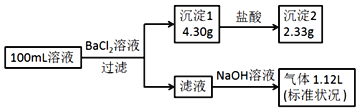
A. ԭ��Һһ������CO32����SO42����һ��������Fe3+
B. ԭ��Һһ������Cl�������ܴ���Na+
C. ԭ��Һ��c��Cl������0.1molL��1
D. ��ԭ��Һ�в�����Na+����c��Cl������0.1molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֱ���ŷ�SO2��NO2��Σ����������ҵ�ϳ����û�ѧ����������Ⱦ��
(1)��ͼ��1mol CH4��ȫȼ��������̬ˮ�������仯��1molS(g)ȼ�յ������仯��
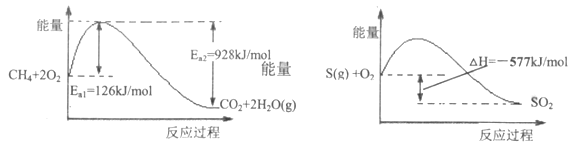
��CH4��ȫȼ�յĻ����_____________kJ/mol
���ڴ��������£�CH4���Ի�ԭSO2���ɵ���S(g)��H2O(g)��CO2��д���÷�Ӧ���Ȼ�ѧ����ʽ_____________________________��
(2)Ϊ����SO2�ŷţ�����SO2������ͨ��ϴ�Ӽ�X��������պ��������պ����Һ�м���ϡ���ᣬ�ȿ��Ի���![]() ��ͬʱ�ֿɵõ����ʡ�X������__________(�����)��
��ͬʱ�ֿɵõ����ʡ�X������__________(�����)��
a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3H2O
(3)��NO2+SO2![]() SO3+NO ��H<0��Ӧ����̽�����ڹ̶�������ܱ������У�ʹ��ij�ִ������ı�ԭ������Ƚ��ж���ʵ��(����ʵ����¶ȿ�����ͬ��Ҳ���ܲ�ͬ)���ⶨNO2��ƽ��ת���ʡ�ʵ������ͼ��ʾ��
SO3+NO ��H<0��Ӧ����̽�����ڹ̶�������ܱ������У�ʹ��ij�ִ������ı�ԭ������Ƚ��ж���ʵ��(����ʵ����¶ȿ�����ͬ��Ҳ���ܲ�ͬ)���ⶨNO2��ƽ��ת���ʡ�ʵ������ͼ��ʾ��

���ܹ��ӿ�û�ѧ��Ӧ���ʵ����������___________________
a.�����¶� b.����ѹǿ c.�����¶� d.��Сѹǿ
�����Ҫ��ͼ��C���ƽ��״̬�ı�ΪB���ƽ��״̬��Ӧ��ȡ�Ĵ�ʩ��___________��
����A���Ӧʵ���У�SO2(g)����ʼŨ��Ϊc0mol/L������![]() min�ﵽƽ��״̬����ʱ�λ�ѧ��Ӧ����v(NO2)___mol/(Lmin)��
min�ﵽƽ��״̬����ʱ�λ�ѧ��Ӧ����v(NO2)___mol/(Lmin)��
��ͼ��C��D�����Ӧ��ʵ���¶ȷֱ�Ϊ![]() ��
��![]() �������ж�
�������ж�![]() ______
______![]() (���������)
(���������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��һ�ַḻ����Դ����ҵ�ϿɴӺ�ˮ����ȡ�������ʣ��㷺Ӧ��������������Ƽ��ȷ��档��ͼ��ij�����Ժ�ˮ��Դ�����ۺ����õ�ʾ��ͼ��

�ش��������⣺
(1)����ͼ�в���a������Ϊ________��(�����)
A�������ᾧ B�����½ᾧ
(2)������ʯ�ҵķ���ʽ__________________________�������ӷ�Ӧ�ĽǶ�˼��������ˮ�м���ʯ�����������____________________��
(3)þ��һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�Ӻ�ˮ����ȡ��
����Ҫ��֤������ˮMgCl2�в���NaCl����IJ���������_____________��
�ڲ���b����________��Χ�н��У����ڿ����м��ȣ��������Mg(OH)2��
д���йط�Ӧ�Ļ�ѧ����ʽ��________________________________________��
(4)��ˮMgCl2������״̬�£�ͨ�������Mg��Cl2���÷�Ӧ�Ļ�ѧ����ʽΪ__________���ӿ��dzɱ��ͷ���ѭ�����õĽǶȣ�������������������_______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com