
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | (1) | (2) | ||||||
| 三 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 四 | (10) | (11) | (12) |
 .
. .
. 分析 (1)由元素在周期表中位置可知,(1)为N、(2)为F、(3)为Na、(4)为Mg、(5)为Al、(6)为C、(7)为S、(8)为Cl、(9)为Ar、(10)为K、(11)为Ca、(12)为Br;
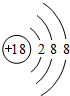
(2)稀有气体Ar的化学性质最不活泼,原子核外电子数为18,核外有3个电子层,各层电子层为2、8、8;
(3)上述元素中,最高价氧化物对应水化物酸性最强为高氯酸,成两性的为氢氧化铝,碱性最强的为KOH;
(4)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(5)元素(8)、(11)和氧元素形成一种广泛使用杀菌消毒剂为Ca(ClO)2;
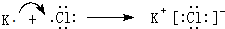
(6)元素(8)和(10)为KCl,由钾离子与氯离子过程,用K原子、Cl原子电子式表示其形成过程.
解答 解:(1)由元素在周期表中位置可知,(1)为N、(2)为F、(3)为Na、(4)为Mg、(5)为Al、(6)为C、(7)为S、(8)为Cl、(9)为Ar、(10)为K、(11)为Ca、(12)为Br,
故答案为:N;Si;
(2)稀有气体Ar的化学性质最不活泼,原子核外电子数为18,核外有3个电子层,各层电子层为2、8、8,原子结构示意图为 ,
,
故答案为: ;
;
(3)上述元素中,最高价氧化物对应水化物酸性最强为高氯酸,成两性的为氢氧化铝,碱性最强的为KOH,
高氯酸与氢氧化铝反应方程式为:3HClO4+Al(OH)3=Al(ClO4)3+3H2O,氢氧化钾与氢氧化铝反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:3HClO4+Al(OH)3=Al(ClO4)3+3H2O;Al(OH)3+OH-=AlO2-+2H2O;
(4)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:Cl->K+>F->Na+,
故答案为:Cl->K+>F->Na+;
(5)元素(8)、(11)和氧元素形成一种广泛使用杀菌消毒剂为Ca(ClO)2,含有离子键、共价键,
故答案为:离子键、共价键;
(6)元素(8)和(10)为KCl,由钾离子与氯离子过程,用K原子、Cl原子电子式表示其形成过程为: ,
,
故答案为: .
.
点评 本题考查元素周期表与元素周期律综合应用,需要学生熟练掌握元素周期表的结构,注意理解掌握用电子式表示化学键或物质的形成,难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:填空题
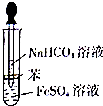 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结 构 模 型 示 意 图 | 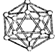 | 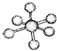 | 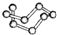 |  |
| 备注 | 熔点1873K | 易溶于CS2 |
| A. | 单质硼属于原子晶体,结构单元中含有30个B-B键,含有20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | HCN的结构式为H-C≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2Y3 | B. | X3Y2 | C. | Y2X3 | D. | Y3X2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃前甲烷不必验纯 | |
| B. | 甲烷燃烧能放出大量的热,所以是一种很好的气体燃料 | |
| C. | 煤矿的矿井要注意通风和严禁烟火,以防爆炸事故的发生 | |
| D. | 甲烷是一种具有正四面体结构的很稳定的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn2C | B. | Al4C3 | C. | Mg2C3 | D. | Li2C2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com