
甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的百分含量分别为30.4%和25.9%.若已知甲的分子式是XY2,则乙的分子式只可能是()
| A. | XY | B. | X2Y | C. | X2Y3 | D. | X2Y5 |
| 元素质量分数的计算. | |
| 专题: | 压轴题;演绎推理法. |
| 分析: | 由甲的化学式为XY2,可得其中X、Y原子个数比=1:2;根据甲、乙两种化合物中X元素的质量分数分别为30.4%和25.9%,可知甲物质中元素X的质量分数大于乙物质,可判断乙物质中X、Y原子个数比应小于1:2. |
| 解答: | 解:A、由化学式XY,其中X、Y原子个数比=1:1,大于1:2;故A不正确; B、由化学式X2Y,其中X、Y原子个数比=2:1,大于1:2;故B不正确; C、由化学式X2Y3,其中X、Y原子个数比=2:3,大于1:2;故C不正确; D、由化学式X2Y5,其中X、Y原子个数比=2:5,小于1:2,故D正确; 故选D. |
| 点评: | 解答本题时若按常规思维来做,计算量较大,由两物质中X元素含量大小推断出两物质中原子个数比的关系是解题的技巧所在. |


科目:高中化学 来源: 题型:
下列判断正确的是( )
A.0.1 mol·L-1盐酸和0.1 mol·L-1醋酸分别与2 mol·L-1 NaOH 反应的速率相同
B.0.1 mol·L-1 盐酸和0.1 mol·L-1 HNO3分别与大小相同的大理石反应的速率相同
C.Mg和Fe与0.1 mol·L-1盐酸反应速率相同
D.大理石与大理石粉分别与0.1 mol·L-1 盐酸反应的速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0 ~6.0之间,通过电解生成Fe(OH)3 沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计如图所示装置示意图。
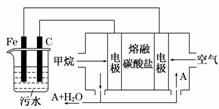
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
A.BaSO4 B.CH3CH2OH
C.Na2SO4 D.NaOH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:
Ⅰ.______________;Ⅱ.______________。
(3)电极反应Ⅰ和Ⅱ的生成物反应得到Fe(OH)3沉淀的离子方程式是________________________________________________________________________。
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知FeCl3溶液与KSCN溶液混合后发生反应FeCl3+3KSCNFe(SCN)3+3KCl,达到平衡后,改变条件,则下列说法正确的是( )
A.向溶液中加入少许KCl固体,溶液颜色变浅
B.升高温度,平衡一定发生移动
C.加入少许KCl固体或者加入少许FeCl3固体平衡常数均发生变化,且变化方向相反
D.平衡常数表达式为K=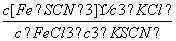
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6g硫化氢④0.2mol NH3.下列对这四种气体的关系从小到大表示不正确的是()
| A. | 体积:④<①<②<③ | B. | 密度:①<④<③<② | |
| C. | 质量:④<①<③<② | D. | 氢原子数:②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了10.5g,则这种元素是()
| A. | K | B. | Mg | C. | Al | D. | Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
表示溶液中浓度的方法通常有两种:溶液中溶质的质量分数(%)和物质的量浓度(C),因此在配制溶液时,根据不同的需要,有不同的配制方法,如:(请完成填空)
(1)用10%(密度为1.01g/cm3)的氢氧化钠溶液配制成27.5g2%的氢氧化钠溶液.
①计算:需5.5g10%(密度为1.01g/cm3)的氢氧化钠溶液,其体积为5.4mL,需加22mL水(ρ水=1g/cm3)进行稀释.
②量取:用10ml量筒取10%氢氧化钠,量取时视线要跟量筒凹液面的最低处保持水平,然后倒入烧杯里,用25ml量筒量取蒸馏水也注入烧杯里.
③溶解:用玻璃棒将上述溶液搅拌均匀,即得27.5g2%的氢氧化钠溶液.
(2)用98%(密度为1.84g/cm3)的浓硫酸稀释成3mol/L的稀硫酸100mL,回答下列问题:
①需要取浓硫酸16.3mL;
②配制操作可分解成如下几步,以下正确的操作顺序是ADECBHGF.
A、向容量瓶中注入少量蒸馏水,检查是否漏水
B、用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C、用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D、根据计算,用量筒量取一定体积的浓硫酸
E、将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F、盖上容量瓶塞子,振荡,摇匀
G、用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H、继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
(3)实验室需配制1mol•L﹣1的NaOH溶液和1mol•L﹣1的H2SO4溶液各100mL.
①要配制NaOH溶液,在用托盘天平称取NaOH固体时,天平读数为C.(填代号)
A.4.0g B.4.00g C.>4.0g
②在配制NaOH溶液和H2SO4溶液的各步操作中,有明显不同的是AB.
A.称量或量取 B.溶解 C.移液、洗涤 D.定容.
查看答案和解析>>
科目:高中化学 来源: 题型:
冰箱致冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl+O3(臭氧)→ClO+O2 ClO+O﹣→Cl+O2 下列说法不正确的是()
| A. | 反应将O3转变为O2 | B. | Cl原子是总反应的催化剂 | |
| C. | 氟氯甲烷是总反应的催化剂 | D. | Cl原子反复起分解O3的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,错误的是
A.酸碱中和反应属放热反应
B.化学变化中的能量变化主要由化学键变化引起的
C.煤、石油、天然气是当今世界最重要的三种化石燃料
D.相同条件下,1mol石墨转化为金刚石要吸收1.895kJ热量,说明金刚石比石墨稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com