
【题目】关于下列各图的叙述,正确的是( )
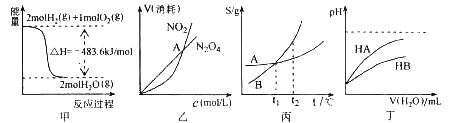
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJmol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液
【答案】C
【解析】
试题分析:A.在101kPa时,1mol可燃物完全燃烧生成稳定氧化物时所放出的热量.使用燃烧热时要注意两个关键点:①反应物用量:可燃物为1mol;②产物要求:充分燃烧成稳定氧化物(如H→H2O),本题生成的水为气体,不是燃烧热,故A错误;B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)N2O4(g)中,各物质的浓度与其消耗速率之间的关系,横坐标向右表示浓度增大,纵坐标向上表示物质消耗速率快,如果达到平衡状态,则二者消耗速率之比等于化学计量数之比即应该等于2:1,故B错误;C.将A、B饱和溶液分别由T1℃升温至T2℃时两溶液中溶质和溶剂的量都不会改变,而二者T1℃溶解度相同,即浓度相同,所以T2℃时溶质的质量分数相等,故C正确;D.常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化可知酸性HA大于HB,所以NaB溶液中B水解程度大,即同浓度的NaA溶液的pH小于NaB溶液,故D错误;故选C。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】 下列事实中,不能用勒夏特列原理揭示的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压回颜色变深
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业上生产硫酸的过程中使用过量的空气以提高SO2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易水解,易被氧化。某研究小组设计SnSO4制备路线如下:
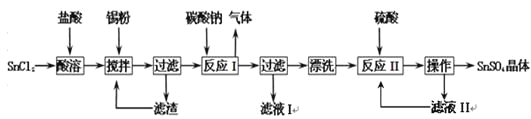
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是 ;
(2)反应I得到的沉淀是SnO,得到该沉淀的离子方程式是 ;
(3)在反应I得到沉淀SnO后,要进行“过滤”、“漂洗”,检验SnO是否洗涤干净的操作是 ;
(4)反应II之后的“操作”依次为 、 、过滤、洗涤、低温干燥;
(5)某化学兴趣小组对用于微电子器件生产的锡粉进行了纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3溶液;③用0.2000 mol/L 酸性K2Cr2O7溶液滴定(产物中Cr呈+3价)至终点,消耗K2Cr2O7溶液15.00 mL。写出酸性K2Cr2O7溶液滴定的离子方程式 ,则此锡粉样品中锡的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁片与稀硫酸反应制取氢气时,下列的措施中不能使氢气生成速率加快的是( )
A.滴加少量硫酸铜溶液
B.不用铁片,改用铁粉
C.不用稀硫酸,改用98%浓硫酸
D.加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的是
①用尿素和甲醛制脲醛树脂包括加成反应和缩聚反应。
②标准状况下,22.4 L甲醛所含电子数约为16 NA 。
③甲醇通常是一种有毒气体,分子中只含极性键
④苯酚与碳酸钠溶液的反应:![]() [
[
⑤ 的名称为:2,2,4-三甲基-4-戊烯
的名称为:2,2,4-三甲基-4-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
A.①②④⑥ B.②④⑥ C.②⑤ D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.1100OC时,在恒容密闭容器中,发生可逆反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
并达到平衡,请完成下列各题:
(1)达到平衡时的平衡常数表达式K=_______________。降低温度,K值减小,则正反应为____________(填“吸热”或“放热”)反应。
(2)向该容器中分别加入以下物质,对平衡的影响如何?
A.正向移动 B.逆向移动 C.不发生移动
①加入少量Na2SO4,则平衡:__________(填所选字母)
②加入少量灼热的Fe3O4 ,则平衡:_________(填所选字母)
II.将CH4设计成燃料电池,其利用率更高,装置示意如右图

(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。
①0<V≤44.8L时,电池总反应方程式为________________;
②44.8L<V≤89.6L时,负极电极反应为_________________;
③V=67.2L时,溶液中阴离子浓度大小关系为____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为短周期内原子半径依次增大的元素,X、 Y、M、N分别由这四种元素中的两种组成的常见化合物,甲、 乙为其中两种元素对应的单质。若X与Y、甲与乙摩尔质量相同,Y与乙均为淡黄色固体,上述物质之间的转化关系如下图所示(部分反应物或生成物省略),则下列说法中不正确的是

A. 相对分子质量M>N,沸点N>M
B. 简单离子半径:C2—>B2—>D+>A+
C. A、C、D的常见氧化物相互之间一定能反应
D. D与其他元素均能形成离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com