
【题目】在体积都为1L、pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下列各图所示内容比较符合客观事实的是
A.  B.
B.  C.
C.  D.
D. 
【答案】C
【解析】
n(Zn)=0.65g÷65g/mol=0.01mol,n(HCl)=0.01mol/L×1L=0.01mol,CH3COOH是弱电解质,醋酸浓度大于盐酸,所以等pH、等体积的醋酸和盐酸,n(CH3COOH)>n(HCl)=0.01mol,酸和Zn反应离子方程式为Zn+2 H+=Zn2++H2↑,根据方程式知,锌剩余0.005mol,CH3COOH溶液中存在电离平衡,平衡状态下的H+不足,但随着反应进行,CH3COOH又电离出H+进行反应,放出的氢气一定比HCl多,开始时由于c(H+)相同,开始的反应速率相同,反应过程中CH3COOH溶液中的c(H+)始终比HCl溶液中的c(H+)大,所以反应速率快;反应后,CH3COOH有剩余,导致CH3COOH溶液pH小于盐酸溶液,A.通过以上分析知,开始时,二者溶液中pH相等,随着反应的进行,醋酸电离出部分氢离子,且最终反应后产生有剩余,所以醋酸pH<HCl,当HCl完全反应后,溶液中pH不变,A错误;B.反应速率与c(H+)成正比,开始时c(H+)相等所以其反应速率相等,但随着反应进行,HCl中c(H+)小于CH3COOH,所以反应速率CH3COOH>HCl,B错误;C.等pH、等体积的醋酸和盐酸,n(CH3COOH)>n(HCl)=0.01mol,与足量锌反应时,生成氢气的量取决于酸的物质的量,所以生成氢气的量CH3COOH>HCl,反应速率与离子浓度成正比,反应过程中c(H+):CH3COOH>HCl,所以醋酸反应时间短,C正确;D.CH3COOH是弱电解质、HCl是强电解质,随着反应的进行,CH3COOH继续电离,所以反应过程中c(H+):CH3COOH>HCl,但都是减小的,当酸完全反应后,c(H+):不变,反应速率与离子浓度成正比,反应过程中c(H+):CH3COOH>HCl,所以醋酸反应时间短,D错误,答案选C。


科目:高中化学 来源: 题型:
【题目】下列分子中含有sp2sp3σ键的是( )
A. CH3CH3 B. CH2===CH-CH===CH2
C. CH≡C-CH3 D. CH2===CH-CH2-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是

A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作正极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能源的理解或说法错误的是
A. 煤、石油、太阳能、风能等均属于新能源
B. 乙醇是一种可再生能源,可代替汽油作为汽车燃料
C. 氢气是最轻的燃料,是具有广阔发展前景的能源
D. 研发开采可燃冰(水合甲烷)的技术,可大大缓解能源危机
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3溶液与KSCN溶液混合时存在平衡:Fe3+(aq)+SCN-(aq)Fe(SCN)2+(aq)。已知某一条件下,反应达到平衡时,Fe(SCN)2+的物质的量浓度与温度的关系如图所示,下列说法正确的是( )
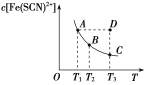
A.该反应为吸热反应
B.T1、T2时反应的平衡常数分别为K1、K2,则K1>K2
C.反应处于D时,一定有v正大于v逆
D.A点的c(Fe3+)比B点的c(Fe3+)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2N2O5![]() 4NO2+O2开始进行时,c(N2O5)=0.040 8 mol/L。经1 min后,c(N2O5)=0.030 mol/L。则该反应的反应速率为( )
4NO2+O2开始进行时,c(N2O5)=0.040 8 mol/L。经1 min后,c(N2O5)=0.030 mol/L。则该反应的反应速率为( )
A.v(N2O5)=1.8×10-4 mol/(L·s) B.v(N2O5)=1.08×10-2 mol/(L·s)
C.v(NO2)=1.8×10-4 mol/(L·s) D.v(O2)=1.8×10-4 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂贮存方法错误的是( )
A.浓硫酸密封保存
B.氢氟酸保存在玻璃瓶中
C.新制氯水保存在棕色试剂瓶中
D.烧碱溶液可用带橡皮塞的玻璃瓶暂时保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容的密闭容器中充入0.1 mol·L-1 CO2、0.1 mol· L-1 CH4,在一定条件下发生反应:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )

A.上述反应的ΔH<0
B.压强:p4>p3>p2>p1
C.1 100 ℃时该反应的平衡常数为1.64
D.压强为p4时,在y点:v正>v逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com