
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
 Al(OH)3+3H+ (NH4)2CO3
Al(OH)3+3H+ (NH4)2CO3 Al(OH)3+3H+
Al(OH)3+3H+

科目:高中化学 来源:不详 题型:填空题
| 物质 | Fe(OH)3 | Fe (OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀时pH | 3.7 | 9.6 | 6.7 |
| Ksp | 4.0×10–38 | 8.0×10–16 | 2.2×10–20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+、NH4+、SCN-、Cl- | B.Ba2+、H+、NO3-、SO42- |
| C.Fe2+、Fe3+、Na+、NO3- | D.Fe2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3 HCO3-+H+ HCO3-+H+HCO3-  CO32-+H+ CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| C6H5OH | C6H5OH C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | - |
| H3PO4 | H3PO4 H2PO4-+H+ H2PO4-+H+H2PO4-  HPO42-+H+ HPO42-+H+HPO42-  PO43-+H+ PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 | - |
| NH3·H2O | NH3·H2O OH-+NH4+ OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s) Ba2++SO42- Ba2++SO42- | - | 1.07×10-10 |
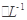 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度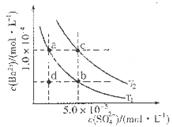
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH—、NO3—、SO42— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水电离的c(H+)=1×10-13mol/L的溶液中:Na+、Ba2+、Cl—、NO3— |
| B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- |
| C.在酸性条件下:Fe2+、Cl-、NO3-、K+ |
| D.在无色溶液中:Al3+、Cl-、 K+、AlO2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将SO2通入BaCl2溶液中 | B.将NH3通入AgNO3溶液中 |
| C.将Cl2通入AgNO3溶液中 | D.将NO2通入Ca(OH)2溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com