
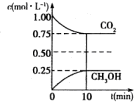
 (1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
(1)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3molH2,发生的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-aKJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.分析 (1)①据v(CH3OH)=$\frac{△c(C{H}_{3}OH)}{△t}$求得甲醇的反应速率,再据速率之比等于化学计量数之比,求氢气的反应速率;
②化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
③要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,则根据反应,平衡向正反应方向移动即可;
④根据图象数据结合平衡常数K的计算公式进行计算,根据K仅与温度有关及反应为放热来判断改变条件;
(2)①Ka=$\frac{c(HC{{O}_{3}}^{-})•c({H}^{+})}{c({H}_{2}C{O}_{3})}$,Ka=10-6.1mol•L-1,正常血液中c(HCO3-):c(H2CO3)≈20:1;
②正常血液中c(HCO3-):c(H2CO3)≈20:1,碳酸氢根离子浓度大于碳酸浓度,溶液呈碱性;
③根据血液中存在的电离平衡分析,HCO3-、CO32-均水解显碱性.
解答 解:(1)①v(CH3OH)=$\frac{△c(C{H}_{3}OH)}{△t}$=$\frac{0.25mol/L}{10min}$=0.025mol/(L•min),则v(H2)=3×0.025mol/(L•min)=0.075mol/(L•min),
故答案为:0.075mol/(L•min);
②A.CO2的体积分数在混合气体中保持不变,则能说明达到平衡状态,故A正确;
B.混合气体的平均相对分子质量=$\frac{混合气体的质量总和}{混合气体的物质的量总和}$,混合气体的质量始终不变,反应前后气体物质的量不相同,平均相对分子质量不变,说明混合气体的物质的量不变,则各组分物质的量不变,反应达到平衡状态,故B正确;
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O,不能体现正逆反应,故不能说明达到平衡状态,故C错误;
D.H2O与CH3OH都是产物,并且按照1:1的比例生成,所以H2O与CH3OH的物质的量浓度之比一直为1:1,不能说明达到平衡状态,故D错误;
故答案为:AB;
③要使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,则根据反应,
A.升高温度,平衡逆向移动,所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$减小,故A错误;
B.恒温恒容下充入He(g),平衡不移动,所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$不变,故B错误;
C.将H2O(g)从体系中分离,平衡正向移动,所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故C正确;
D.恒温恒容再充入2mol CO2和3mol H2,等效于开始加入4molCO2和6molH2,压强增大,平衡正向移动,所以$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,故D正确;
故选:CD;
④由图象数据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)得
开始浓度:1 1.5 0 0
转化浓度:0.25 0.75 0.25 0.25
平衡浓度:0.75 0.75 0.25 0.25
所以K=$\frac{0.25×0.25}{0.75×0.7{5}^{3}}$=0.20,则要使K=1,又反应放热所以降低温度使平衡向正反应方向移动,
故答案为:0.20;C;
(2)①Ka=$\frac{c(HC{{O}_{3}}^{-})•c({H}^{+})}{c({H}_{2}C{O}_{3})}$,Ka=10-6.1mol•L-1,正常血液中c(HCO3-):c(H2CO3)≈20:1,则c(H+)=10-7.4mol•L-1,则pH=7.4,
故答案为:7.4;
②正常血液中c(HCO3-):c(H2CO3)≈20:1,碳酸氢根离子浓度大于碳酸浓度,溶液呈碱性,溶液中离子浓度大小为c(HCO3-)>c(H2CO3)>c(OH-)>c(H+);
故答案为:c(HCO3-)>c(H2CO3)>c(OH-)>c(H+);
③血液是缓冲溶液,缓冲溶液可以抵御外来少量酸或碱对溶液pH的影响,当少量酸进入血液中时,HCO3-就与H+发生反应来维持血液的pH稳定,当少量碱进入血液中时,H2CO3就与OH-发生反应来维持血液的pH稳定;
故答案为:当少量酸进入血液中时,HCO3-就与H+发生反应来维持血液的pH稳定,当少量碱进入血液中时,H2CO3就与OH-发生反应来维持血液的pH稳定.
点评 本题考查了化学平衡的有关知识,缓冲溶液及盐类水解,平衡影响因素,离子浓度大小比较,明确习题中的信息及有关Ka的计算是解答本题的关键,题目难度中等.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 标有“ ”的包装材料可以用来包装食品 ”的包装材料可以用来包装食品 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | GaN中的氮和镓均属于第IIIA族元素 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液呈碱性的原因是:CO32-+2H2O?H2CO3+2OH- | |
| B. | 电解MgCl2水溶液的离子方程式:2Cl-+2 H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 质量数之和是质子数之和两倍的水分子符号可能是:D216O | |
| D. | 固体酒精是餐桌上常用的燃料,已知酒精的标准燃烧热是-1366.8kJ•mol-1,则表示酒精标准燃烧热的热化学方式式为: C2H5OH(s)+3O2(g)=2CO2(g)+2 H2O(l)△H=-1366.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “静电除尘”、“汽车尾气的催化净化”都有利于提高空气的质量 | |
| B. | 减少化石燃料的使用,有利于降低空气中PM2.5的含量 | |
| C. | 石油的分馏是获得芳香烃的主要途径 | |
| D. | 医用酒精是用淀粉类植物发酵经蒸馏、加工制成,浓度通常是75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油是混合物,其分馏产品汽油也是混合物 | |
| B. | NH4I的电子式: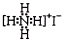 | |
| C. | 糖类、蛋白质和乙酸都是人体必需的营养物质 | |
| D. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 选用试剂(过量) | 操作方法 | |
| A | Cu(CuO) | 氧气 | 通入氧气并加热 |
| B | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| C | N2(O2) | 铜粉 | 气体通过炽热的铜粉 |
| D | KCl溶液(K2CO3) | 氯化钙溶液 | 加入氯化钙溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com