
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________________.
(2)除去蒸馏水中溶解的O2常采用______的方法.
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是_________________________________.
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
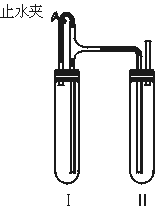
(1)在试管Ⅰ里加入的试剂是____________________________.
(2)在试管Ⅱ里加入的试剂是____________________________.
(3)为了制得白色Fe(OH2)沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是______________________________________________________.
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是______________________.
科目:高中化学 来源:2007年全国百校调研高一第二次月考卷 化学物质及其变化 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
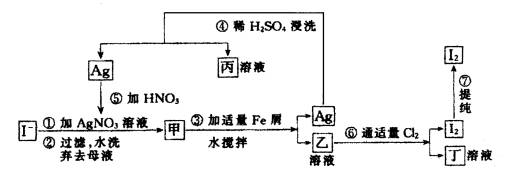
(1)乙、丁中溶质的分子式:乙 ,丁 。
(2)第④步操作中用稀H2SO4浸洗的目的是 (填写字母编号)
a.除去未反应的NO![]() b.除去未反应的I-
b.除去未反应的I-
c.除去未反应的Fe d.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是 和 (不要求写具体步骤)。
(4)实验室检验I2的方法是 。
(5)甲物质见光易变黑,其原因是(用化学方程式表示) 。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
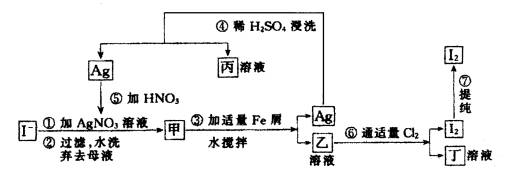
(1)乙、丁中溶质的分子式:乙 ,丁 。
(2)第④步操作中用稀H2SO4浸洗的目的是 (填写字母编号)
a.除去未反应的NO![]() b.除去未反应的I-
b.除去未反应的I-
c.除去未反应的Fe d.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是 和 (不要求写具体步骤)。
(4)实验室检验I2的方法是 。
(5)甲物质见光易变黑,其原因是(用化学方程式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(15分)随着信息产业的高速发展和家用电器的普及,我国印刷电路板(PCB)的生产呈现急剧增长之势。废旧电路板的增多给我们带来了环境问题,目前我们台州大多采用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜,从而进行对铜的回收和利用。经分析腐蚀废液中主要含有HCl 、FeCl2和CuCl2等溶质。
(1)用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜的原理是
(用离子方程式表示): ▲ 。
(2)工业上有多种回收腐蚀废液中铜的方法,下面是常用的两种方法:
Ⅰ、电化学方法回收腐蚀废液中铜,则阳极(石墨)上的电极反应式为: ▲ 。
Ⅱ、工业上也可以用铁粉回收腐蚀废液中的铜:
①用铁粉回收铜的实验操作为 ▲ 。
②科学家对铁置换铜工艺的研究如下:
分别用还原铁粉、废铁屑和废铁屑在超声波粉碎处理下置换铜,将置换出的铜粉放入250mL烧杯中,加入120mL 1.5 mol·L-1的硫酸,水浴加热,控制温度在70 ℃ ,搅拌,在10、20、30、40、50、60min时,分别用吸管移取0.5g左右的铜于试管内,将上层清液倒回小烧杯中,用蒸馏水洗净试样,过滤,在105℃烘箱中烘干后测定铜粉中铁的含量。其结果如图所示。
已知a表示用还原铁粉置换铜的除铁效果,b表示用废铁屑置换铜的除铁效果,c表示用废铁屑在超声波下置换铜的除铁效果,你认为除铁效果最好的是 ▲ (填a、b或c),其原因是 ▲ 。
(3)工业上也可用腐蚀废液生成CuCl2·2H2O,从而进行对废液的利用,其工艺流程如下:
已知:pH ≥9.6时,Fe2+ 以Fe(OH)2 的形式完全沉淀; pH ≥6.4时,Cu2+ 以Cu(OH)2的形式完全沉淀; pH在3~4时,Fe3+ 以Fe(OH)3 的形式完全沉淀。
①试剂A最好应选用 ▲ 。
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液
理由是 ▲ 。
②分析有关物质的溶解度曲线(如下图),为了获得CuCl2·2H2O晶体,对滤液B进行的操作是: ▲ 、 ▲ ,过滤得到产品。
③测定CuCl2·2H2O产品的质量分数可按下法:取2.000g产品,用水溶解后,加入60.00 mL 0.4000 mol·L-1的KI溶液(足量),充分反应后加入淀粉指示剂,用0.4000 mol·L-1 Na2S2O3标准溶液滴定,耗去此标准液25.00 mL时,刚好到达滴定终点。
已知:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
此产品中CuCl2·2H2O的质量分数为 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省台州市高三上学期期末考试化学试卷 题型:填空题
(15分)随着信息产业的高速发展和家用电器的普及,我国印刷电路板(PCB)的生产呈现急剧增长之势。废旧电路板的增多给我们带来了环境问题,目前我们台州大多采用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜,从而进行对铜的回收和利用。经分析腐蚀废液中主要含有HCl 、FeCl2和CuCl2等溶质。
(1)用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜的原理是
(用离子方程式表示): ▲ 。
(2)工业上有多种回收腐蚀废液中铜的方法,下面是常用的两种方法:
Ⅰ、电化学方法回收腐蚀废液中铜,则阳极(石墨)上的电极反应式为: ▲ 。
Ⅱ、工业上也可以用铁粉回收腐蚀废液中的铜:
①用铁粉回收铜的实验操作为 ▲ 。
②科学家对铁置换铜工艺的研究如下:
分别用还原铁粉、废铁屑和废铁屑在超声波粉碎处理下置换铜,将置换出的铜粉放入250mL烧杯中,加入120mL 1.5 mol·L-1的硫酸,水浴加热,控制温度在70 ℃ ,搅拌,在10、20、30、40、50、60min时,分别用吸管移取0.5g左右的铜于试管内,将上层清液倒回小烧杯中,用蒸馏水洗净试样,过滤,在105℃烘箱中烘干后测定铜粉中铁的含量。其结果如图所示。

已知a表示用还原铁粉置换铜的除铁效果,b表示用废铁屑置换铜的除铁效果,c表示用废铁屑在超声波下置换铜的除铁效果,你认为除铁效果最好的是 ▲ (填a、b或c),其原因是 ▲ 。
(3)工业上也可用腐蚀废液生成CuCl2·2H2O,从而进行对废液的利用,其工艺流程如下:
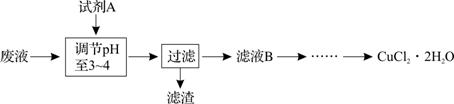
已知:pH ≥9.6时,Fe2+ 以Fe(OH)2 的形式完全沉淀; pH ≥6.4时,Cu2+ 以Cu(OH)2的形式完全沉淀; pH在3~4时,Fe3+ 以Fe(OH)3 的形式完全沉淀。
①试剂A最好应选用 ▲ 。
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液
理由是 ▲ 。
②分析有关物质的溶解度曲线(如下图),为了获得CuCl2·2H2O晶体,对滤液B进行的操作是: ▲ 、 ▲ ,过滤得到产品。

③测定CuCl2·2H2O产品的质量分数可按下法:取2.000g产品,用水溶解后,加入60.00 mL 0.4000 mol·L-1的KI溶液(足量),充分反应后加入淀粉指示剂,用0.4000 mol·L-1 Na2S2O3标准溶液滴定,耗去此标准液25.00 mL时,刚好到达滴定终点。
已知:2Cu2++4I-=2CuI↓+I2 I2+2S2O32-=2I-+S4O62-
此产品中CuCl2·2H2O的质量分数为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com