
| X | Y | ||
| Z | W |
| A. | 同价态氧化物的沸点:Z>X | |
| B. | 单质的氧化性:W>Z | |
| C. | Y和W可以同时存在于同一离子化合物中 | |
| D. | 它们都只能形成一种气态氢化物 |
分析 X、Y、Z、W是元素周期表中短周期元素,由四种元素在周期表中的相对位置,可知X和Y处于第二周期、Z和W处于第三周期,它们都属于中学化学重点研究的对象,说明均为主族元素,X、Y、Z、W应分别为C、N、S、Cl.
A.均形成分子晶体,相对分子质量越大,沸点越高;
B.同周期自左而右非金属性增强,单质的氧化性增强;
C.Y和W可以同时存在于同一离子化合物中,如NH4Cl等;
D.碳元素可以形成多种气态氢化物.
解答 解:X、Y、Z、W是元素周期表中短周期元素,由四种元素在周期表中的相对位置,可知X和Y处于第二周期、Z和W处于第三周期,它们都属于中学化学重点研究的对象,说明均为主族元素,X、Y、Z、W应分别为C、N、S、Cl.
A.均形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高,故A正确;
B.同周期自左而右非金属性增强,氯元素非金属性比硫的强,故氯气的氧化性比硫的强,故B正确;
C.Y和W可以同时存在于同一离子化合物中,如NH4Cl等,故C正确;
D.碳元素可以形成多种气态氢化物,如甲烷、正丁烷、异丁烷等,故D错误.
故选:D.
点评 本题考查结构性质位置关系应用,熟练掌握元素周期表的结构,掌握中学学习的元素化合物知识.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境只有一种,根据分析,下列说法中不正确的是( )
的烃X,红外光谱和核磁共振表明其分子中氢原子的化学环境只有一种,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | X中碳原子的化学环境有2种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
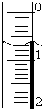
| A. | 钠离子的结构示意图: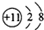 | |
| B. | 氢氧根离子的电子式: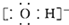 | |
| C. | 原子核内有20个中子的氯原子:${\;}_{17}^{37}$Cl | |
| D. | Na2O与Na2O2中阳离子与阴离子个数比分别为2:1和1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请回答下列问题.
请回答下列问题.| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙醛能发生氧化反应但不能发生还原反应 | |
| B. | 苯酚能与溴水发生取代反应 | |
| C. | 酯化反应是可逆反应 | |
| D. | 乙醇和乙醚互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com