
| A、在c(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- |
| B、在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- |
| C、在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ |
| D、pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+ |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
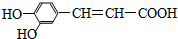 .有关咖啡酸的说法中不正确的是( )
.有关咖啡酸的说法中不正确的是( )| A、咖啡酸可以发生还原、取代、加聚等反应 |
| B、咖啡酸与FeCl3溶液可以发生显色反应 |
| C、1 mol咖啡酸可与4 mol H2发生加成反应 |
| D、1 mol咖啡酸最多能消耗3 mol的NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、t℃时原溶液是饱和溶液 |
| B、t℃时A的溶解度为75g |
| C、若A是CuSO4,则7.5g晶体中含水2.7g |
| D、原溶液中A的质量分数为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- |
| B、向200mL 2mol/L溴化亚铁溶液中通入11.2L的标况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- |
| C、向碳酸氢铵溶液中加过量氢氧化钠溶液并加热:NH4++OH-═NH3↑+H2O |
| D、酸性KMnO4溶液吸收SO2:MnO4-+4H++SO2═Mn2++SO42-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、棉、麻、丝、毛,完全燃烧都只生成CO2和H2O |
| B、煤的干馏和石油的分馏均为物理变化 |
| C、制作快餐盒的聚苯乙烯塑料是易降解塑料 |
| D、“地沟油”经加工处理后可以制肥皂和生物柴油 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ③ | 比较铜和镁的金属活动性强弱 | 用石墨作电极,电解同浓度的Mg(NO3)2、Cu(NO3)2的混合液 |
| ④ | 比较碳和硅两元素非金属性强弱 | 测同温、同浓度Na2CO3和Na2SiO3水溶液的pH |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A、①②④ | B、②③④ |
| C、①③④ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、0.1 mol?L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1 mol?L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-) |
| D、0.01 mol?L-1 NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com