
【题目】下列说法不正确的是
A. 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开
B. 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种
C. 二糖、淀粉、纤维素水解的最终产物都是葡萄糖
D. 芥子醇结构简式是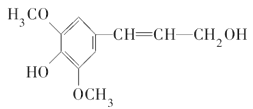 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2
,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2
【答案】C
【解析】A、溴单质易溶于有机溶剂,苯的密度比水小,且不溶于水,从溴水中萃取溴,出现分层,上层为橙红色,下层为水层,CCl4的密度大于水,且不溶于水,从溴水中萃取溴,出现分层,上层为水层,下层为橙红色,乙烯能使溴水褪色,乙醇易溶于水,不出现分层,苯酚与溴水反应生成白色沉淀,因此可以用溴水鉴别,故A说法正确;B、C4H10的结构简式(碳胳形式)为: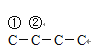 、
、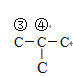 ,羟基的位置有4种,与乙二酸反应生成二元酯,如果是同醇,形成4种,二种不同的醇与乙二酸反应有6种,因此与乙二酸形成二元酯的结构有10种,故B说法正确;C、淀粉和纤维素水解最终产物是葡萄糖,但二糖水解不一定都是葡萄糖,如蔗糖,蔗糖水解成葡萄糖和果糖,故C 说法错误;D、苯环是平面正六边形,乙烯属于平面形,羰基中碳原子是sp2杂化,属于平面结构,醚键中氧原子属于sp2杂化,属于平面结构,因为碳碳单键可以旋转,因此此有机物中所有碳原子可能共面,此有机物中酚羟基的邻位、对位碳原子上没有氢原子,因此不能与溴发生取代,1mol此有机物含有1mol碳碳双键,需要1molBr2发生加成反应,故D说法正确。
,羟基的位置有4种,与乙二酸反应生成二元酯,如果是同醇,形成4种,二种不同的醇与乙二酸反应有6种,因此与乙二酸形成二元酯的结构有10种,故B说法正确;C、淀粉和纤维素水解最终产物是葡萄糖,但二糖水解不一定都是葡萄糖,如蔗糖,蔗糖水解成葡萄糖和果糖,故C 说法错误;D、苯环是平面正六边形,乙烯属于平面形,羰基中碳原子是sp2杂化,属于平面结构,醚键中氧原子属于sp2杂化,属于平面结构,因为碳碳单键可以旋转,因此此有机物中所有碳原子可能共面,此有机物中酚羟基的邻位、对位碳原子上没有氢原子,因此不能与溴发生取代,1mol此有机物含有1mol碳碳双键,需要1molBr2发生加成反应,故D说法正确。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是

A. 图1表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
B. 图2表示除去CuSO4溶液中的Fe3+可采用加入CuO调节溶液pH到4~5
C. 图3表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,则碱性:MOH>ROH
D. 图4为KNO3和NaCl溶解度曲线,若除去NaCl中少量的KNO3,可在较高温度下制得浓溶液后,再冷却结晶、过滤、洗涤、干燥得纯净NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为
A. 1014-a-2b B. 10 a+b-14 C. 10a-2b D. 10a-2b+14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸镁在化工“新型材料”光电领域有着重要的用途。以硼泥[主要成分是MgO(52.1%),还有Fe2O3、FeO、Al2O3、SiO2等杂质]为原料设计制备偏钒酸镁的生产工艺如图所示:
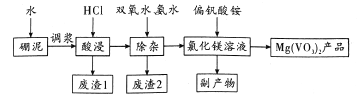
回答下列问题:
(l)Mg(VO3)2 中V的化合价为_____,副产物的电子式为_______。
(2)酸浸时,反应温度需控制在80℃,在实验室可采取的措施为______。写出”酸浸”后溶液中存在的金属阳离子_______,废渣1可用于制作_______,该物质在信息传输中具有重要应用。
(3)“除杂”过程加人双氧水的目的是_______(用离子方程式表示)。此过程中使Fe3+、Al3+浓度均小于l×10-6mol·L-1,在室温下需调节pH范围为__________[已知Ksp[Fe(OH)3]= 1×10-39, Ksp[Al(OH)]=1×10-33, pH=9.3时,Mg2+开始沉淀]。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作:__________。
(5)偏钒酸氨可由VOSO4溶液中加入氯酸钾将其氧化,然后用氨水调节pH即可制得,写出VO2+被氯酸钾氧化的离子方程式_________。
(6)现用a t硼泥生产Mg(VO3)2,若生产过程的产率为6%,则能生产出Mg(VO3)2产品的
质量为_________t (用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是 ( )
A.铝土矿溶于NaOH溶液中 B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体 D.电解熔融的氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大, W与R同主族,且W的氢化物常温时为液态。X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子。
请用化学用语回答下列问题:
(1)Y、Z、W元素的氢化物沸点由高到低的顺序为____________(用化学式表示)。
(2)选取上述六种元素中的某些元素组成的化合物中,写出既含极性键又含非极性键,且相对分子质量最小的物质______________(写电子式)。该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为_______________________________。
(3)请用一个化学方程式证明W元素的非金属性强于R元素_________________________________。
(4)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的Z4气态分子。Z4分子结构如图所示,己知断裂lmolZ-Z 吸收167kJ的热量,生成lmol Z![]() Z放出942kJ热量。试写出Z4气态分子变成Z2气态分子的热化学方程式:_________________________________。
Z放出942kJ热量。试写出Z4气态分子变成Z2气态分子的热化学方程式:_________________________________。

(5)①由X、Z、W三种元素形成的一种离子化合物,其水溶液中离子浓度由大到小的顺序是________________________。
②写出检验该化合物中阳离子的实验操作方法是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com