
| A. | 78 gNa2O2晶体中所含阴阳离子个数均为2NA | |
| B. | 1.5 g CH3+中含有的电子数为NA | |
| C. | 3.4 g氨中含有0.6NA个N-H键 | |
| D. | 常温下,100 mL1 mol•L-1AlCl3溶液中阳离子总数小于0.1NA |
分析 A、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析;
B、求出1.5 g CH3+的物质的量,然后根据CH3+中含8个电子来分析;
C、求出氨气的物质的量,然后根据氨气中含3条N-H键来分析;
D、铝离子水解会导致阳离子个数增多.
解答 解:A、78g过氧化钠的物质的量为1mol,而过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含离子共3NA个,故A错误;
B、1.5 g CH3+的物质的量为0.1mol,而0.1molCH3+中含0.8NA个电子,故B错误;
C、3.4g氨气的物质的量为0.2mol,而氨气中含3条N-H键,故0.2mol氨气中含0.6NA条N-H键,故C正确;
D、铝离子水解会导致阳离子个数增多,故溶液中的阳离子的个数多于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 由2H和18O所组成水22g,其中所含的中子数为11NA | |
| B. | 分子数为NA的N2、CO混合气体体积为22.4L,质量为28g | |
| C. | 标准状况下,22.4LNO和11.2LO2混合后气体的原子总数为3NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3•H2O+H3O+ | |
| B. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 用碳酸氢钠溶液检验水杨酸中的羧基: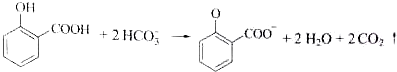 | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | 键能 | 共价键 | 键能 |
| H-H | 436 | H-F | 565 |
| C-F | 427 | H-S | 339 |
| C-Cl | 330 | H-Se | 314 |
| A. | H2(g)→2H (g)-436kJ | |
| B. | 键长越短,共价键越牢固 | |
| C. | 相同条件下CH3F比CH3Cl更 易发生水解反应 | |
| D. | 相同压强下,H2S的沸点比 H2Se的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L Cl4中含CL原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4g白磷中含有P-P键数目为0.6NA | |
| C. | 5.6g铁粉在2.24 L(标准状况)氯气中充分燃烧,失去的电子书为0.3NA | |
| D. | 常温常压下10g46%酒精溶液中含氧原子总数为 0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.89mol/L | B. | 0.82mol/L | C. | 0.78mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子:S-1 | |
| B. | 用电子式表示氯化氢分子的形成过程: | |
| C. | 氢氧根的电子式: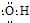 | |
| D. | HClO的结构式:H-O-Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com