
| A. | CO2的电子式为: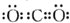 | |
| B. | S2-的离子离子结构示意图是: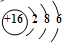 | |
| C. | 原子核内有18个中子的氯原子:3518Cl | |
| D. | HBr电子式为: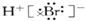 |
分析 A.CO2是共价化合物,其结构式为O=C=O;
B.硫离子最外层含有8个电子;
C.质子数写在左下角,质量数写在左上角;
D.溴化氢为共价化合物,氢原子与溴原子形成了一个共用电子对;
解答 解:A.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为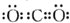 ,故A正确;
,故A正确;
B.硫离子核外存在18个电子,核内有16个质子,最外层达到8电子稳定结构,其离子结构示意图为: ,故B错误;
,故B错误;
C.原子核内有18个中子的氯原子,质子数为17,质量数为35,符号为:3517Cl,故C错误;
D.溴化氢为共价化合物,氢原子与溴原子形成了一个共用电子对,溴化氢中氢原子最外层为2个电子,溴原子最外层达到8电子,用小黑点表示原子最外层电子,则溴化氢的电子式为 ,故D错误;
,故D错误;
故选:A.
点评 本题考查了化学用语,注意掌握常见化学用语的表示方法,该考点是高考考查的热点,本题侧重于对学生基础知识的考查,题目难度中等.


科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
在标准状况下,等质量的CH4 和CO2比较,下列说法中正确的是
A.密度比4:11 B.分子数之比为4:11
C.体积比4:11 D.物质的量之比为4:11
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ,⑧
,⑧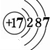 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | L、M的单质与稀硫酸反应速率:M>L | |
| C. | T、Q的氢化物常态下均为无色气体 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+:1s22s22p6 | B. | F:1s22s22p5 | ||
| C. | Cl-:1s22s22p63s23p5 | D. | Mn:1s22s22p63s23p63d54s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
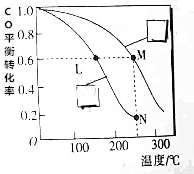 用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应:
用氢气和一氧化碳克制备洁净能源二甲醚(CH3OCH3),工业制备二甲醚时在催化反应室(压强为2.0~10.0MPa,温度为230~280℃)中进行下列反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com