
| A、二氧化硫气体通入到漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B、碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
| C、H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑ |
| D、向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 电解质 | 平衡方程式 | 平衡常数K | ||||||
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | ||||||
| H2CO3 | H2CO3?H++HCO
HCO
|
K1=4.31×10-7 K2=5.61×10-11 | ||||||
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | ||||||
| NH3?H2O | NH3?H2O?NH4++OH- | 1.76×10-5 |
- 3 |
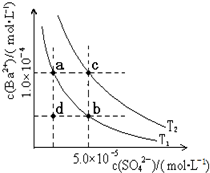
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、均存在电离平衡和水解平衡 |
| B、存在的粒子种类不相同 |
| C、均存在c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) |
| D、均存在c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MgSO4 |
| B、Ba(HCO3)2 |
| C、Mg(HCO3)2 |
| D、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸中:K+、Mg2+、AlO2-、S2O32- | ||
| B、NaHS溶液中:SO42-、K+、Cl-、Cu2+ | ||
C、
| ||
| D、通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | ||
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||
C、实验室用液溴和苯在催化剂作用下制溴苯: +Br2 +Br2
 +HBr +HBr | ||
| D、硝酸银溶液中滴加过量氨水:Ag++NH3?H2O═AgOH↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L Na2CO3溶液:c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+) |
| B、能使紫色石蕊试液呈红色的溶液:Na+、NH4+、I-、NO3-可以大量共存 |
| C、任何条件下,pH=13的氢氧化钠溶液中:c(OH-)=0.1mol/L |
| D、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
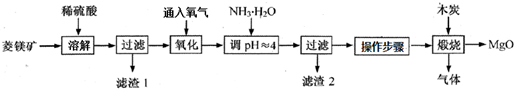
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
| 800℃ |
| 800℃ |
| 800℃ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com