
| ���� | CH3COOH | HCN | H2CO3 |
| K | 1.8��10��5 | 4.9��10��10 | K1=4.3��10��7 K2=5.6��10��11 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c��H+��=c��Cl����+c��OH���� |
| B��������pH=12�İ�ˮ��Ϻ�������Һ������ |
| C����H2O�������c��H+��=1.0��10��12 mol?L��1 |
| D��������0.01 mol?L��1��������Һ��Ϻ�������Һ�У�c��Cl����=c��CH3COO���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���״��е���ʯ����Һ�ʺ�ɫ������ | B���״��붹�����г������� |
| C�����ǽ����ڰ״���������ų����� | D��pH��ֽ��ʾ�����pHΪ2��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
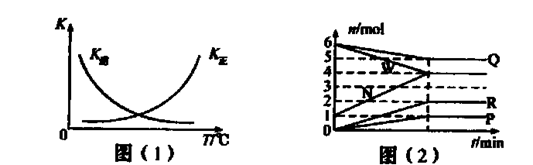
 2G��g��������
2G��g��������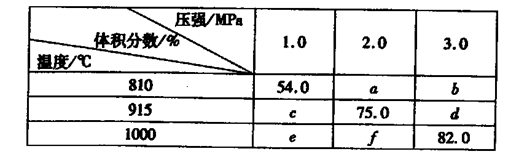
 HCO3��+H+�ĵ��볣��Ka=4��10��7 mo1��L��1������¶��£�NaHCO3��ˮ�ⳣ��Kh= �������ʵ����Թ�ʵ��֤��Na2CO3��Һ�д���CO32��+H2O
HCO3��+H+�ĵ��볣��Ka=4��10��7 mo1��L��1������¶��£�NaHCO3��ˮ�ⳣ��Kh= �������ʵ����Թ�ʵ��֤��Na2CO3��Һ�д���CO32��+H2O  HCO3��+OH������ʵ ��
HCO3��+OH������ʵ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H++HS-��HS-
H++HS-��HS- H++S2-������H2S��Һ��
H++S2-������H2S��Һ�� | A���μ�������ˮ,��ҺpH��С | B��ͨ�����SO2����,��ҺpH���� |
| C����ˮ,��Һ��������Ũ������ | D��������������ͭ����,��������Ũ�ȶ���С |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com