
①26Z,30N,24e- ②26Z,30N,26e- ③36Z,48N,36e- ④36Z,44N,36e- ⑤14Z,14N,14e- ⑥14Z,16N,14e- ⑦33Z,42N,33e- ⑧35Z,44N,35e- ⑨35Z,44N,36e- ⑩35Z,46N,35e-
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
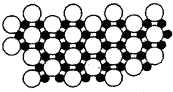 (2013?菏泽二模)[化学-物质结构与性质]
(2013?菏泽二模)[化学-物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
| 操作 | 应该观察到的现象 |
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
查看答案和解析>>
科目:高中化学 来源:导学大课堂必修二化学人教版 人教版 题型:022
根据原子结构分析,在下列①-⑩的十种微粒中,属于原子的是________,属于离子的是________,属于同种元素的是________,属于同位素的是________.(式中Z为质子数,N为中子数,e-为电子数)
①26Z,30N,24e-
②26Z,30N,26e-
③36Z,48N,36e-
④36Z,44N,36e-
⑤14Z,14N,14e-
⑥14Z,16N,14e-
⑦33Z,42N,33e-
⑧35Z,44N,35e-
⑨35Z,44N,36e-
⑩35Z,46N,35e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com