

| c(H2) |
| c(H2O) |
| ||
|
 ,故答案为:
,故答案为: .
.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
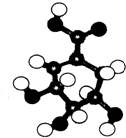 相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如图所示.
相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如图所示.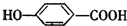 ,试写出该反应的化学方程式
,试写出该反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是
为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图.CO转化率随温度变化的规律是查看答案和解析>>
科目:高中化学 来源: 题型:
 已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生如下反应:
已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生如下反应:| 序号 | A溶液 | B溶液 |
| ① | 2mL0.1mol?L-1 H2C2O4溶液 |
4mL0.01mol?L-1 KMnO4溶液 |
| ② | 2mL0.2mol?L-1 H2C2O4溶液 |
4mL0.01mol?L-1 KMnO4溶液 |
| ③ | 2mL0.2mol?L-1 H2C2O4溶液 |
4mL0.01mol?L-1 KMnO4溶液 少量MnSO4(催化剂) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(A) |
| c(B) |
| c(A) |
| c(B) |
| A、在该温度下,保持容积固定不变,向容器内补充了B气体,则a>b |
| B、保持温度、压强不变,充入惰性气体,则有a<b |
| C、若其他条件不变,升高温度,则有a<b |
| D、若a=b,容器中一定使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
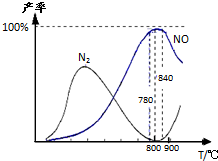 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②:
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②:| A、工业上进行氨催化氧化生成 NO时,温度应控制在780~840℃之间 |
| B、工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率 |
| C、在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率 |
| D、氮气氧化为NO的热化学方程式为:N2(g)+O2(g)?2NO(g);△H=+181.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
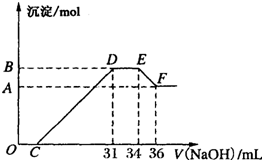 某同学取一定量的Al、Fe混合物,与2.0L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐.在反应后的溶液中,逐滴加入4mol?L-1的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示.分析图象回答问题:
某同学取一定量的Al、Fe混合物,与2.0L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐.在反应后的溶液中,逐滴加入4mol?L-1的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示.分析图象回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2和酸性FeCl2溶液反应:2Fe2++H2O2+2H+=2Fe3++2H2O |
| B、硫化钠水解:S2-+H2O=HS-+OH- |
| C、过量铁粉溶于稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| D、向氢氧化钠溶液中通入少量的CO2:OH-+CO2=HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com