
【题目】实验室用稀硝酸与铜反应制备NO气体,如果采用图Ⅰ装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不是十分理想,因为观察到的现象不能有力证明反应产物是NO。有人设计了图Ⅱ装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。
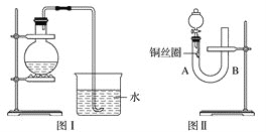
(1)用图Ⅰ装置做实验时,用排水法收集到的气体的颜色为_____色;实验过程中由于______,不易观察到____________生成,从而不能有力证明反应产物是NO。
(2)用图Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到____________为止。
②关闭活塞,用酒精灯在U形管的A侧加热,当______时,立即撤去酒精灯。
(3)根据图Ⅱ装置的实验完成下列问题:
①反应在什么情况下可以自动停止?________________________。
可在何处观察到无色的NO气体?____________________________________________。
②如果将分液漏斗的活塞慢慢打开,可立即观察到哪些明显现象?_________________。
【答案】无 烧瓶中有空气,可以将产生的NO氧化成NO2 无色的NO 液面与橡皮塞接触(或A侧管中恰好充满液体) 铜丝上有气泡产生 当反应产生的NO气体,使铜丝圈与稀硝酸脱离时,反应立即停止 在U形管A侧管内可观察到无色NO气体 U形管B侧管内的稀硝酸又回到A侧管中,分液漏斗中有红棕色气体产生
【解析】
铜与稀硝酸反应:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,为放热反应,NO易被空气中的O2氧化为NO2(红棕色),本题实验Ⅱ中的意图是创设无氧气环境,使NO能存在相当长一段时间,结合NO2的性质解答该题。
(1)NO2可与水反应生成NO,为无色气体,烧瓶内有空气,与生成的NO很快被氧化为红棕色的NO2,不易观察到有无色的NO生成,答案:无;烧瓶中有空气,可以将产生的NO氧化成NO2;无色的NO。
(2)①实验时应将装置内的空气完全排除,则应单孔塞下沿与液面间不留有空隙,否则不能观察到无色气体,
故答案为:液面与橡皮塞接触(或A侧管中恰好充满液体)。
②铜丝与稀硝酸的反应为放热反应,当生成气体时可停止解热,反应放出的热量可维持反应继续进行,
故答案为:铜丝上有气泡产生。
(3)①当铜丝和稀硝酸不接触时,反应会自动停止,在左侧可观察到无色气体,
故答案为:当反应产生的NO气体,使铜丝圈与稀硝酸脱离时,反应立即停止;在U型管A侧管内可观察到无色的NO气体。
②如果再将分液漏斗的活塞慢慢打开,右侧压强大于左侧,U形管B侧管内的稀硝酸又回到A侧管中,NO与空气接触而生成红棕色气体,
故答案为:U形管B侧管内的稀硝酸又回到A侧管中,分液漏斗中有红棕色气体产生。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列粒子浓度关系错误的是
A. 0.1 mol·L-1CH3COONa溶液中:c(Na+)>c(OH-)>c(CH3COOH)>c(H+)
B. pH=5的CH3COOH和CH3COONa混合溶液中:c(CH3COO-)>c(Na+)
C. 将0.2mol·L-1CH3COOH溶液与0.1mo1·L-1NaOH溶液等体积混合:c(CH3COO一)+c(CH3COOH) = 2c(Na+)
D. 向0.10mol·L-1NH4HCO3溶液中通入CO2至中性:c(NH4+) = c(HCO3-)+ c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙烯并验证其性质,请回答下列问题:
(1)写出以乙醇为原料制取乙烯的化学方程式:________________________________________。
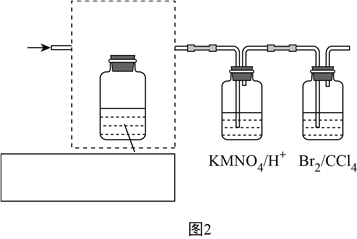
(2)某同学欲使用如图1所示装置制取乙烯,请你改正其中的错误:________________________。
实验过程中发现烧瓶中出现黑色固体,这会导致生成的乙烯中现有杂质气体,请写出生成杂质气体的化学方程式:__________________________________________________。
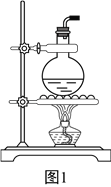
(3)要验证乙烯的化学性质(装置如图2所示,尾气处理装置已略去),请将虚线框中的装置补充完整并标出所有试剂。______________
(4)有些同学提出以溴乙烷为原料制取乙烯,该反应的化学方程式为:____________________。若以溴乙烷为原料,图2中虚线框内的装置(填“能”或“不能”)__________省略,请说明理由:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.光导纤维的主要成分是SiO2
B.工业浓硝酸通常呈黄色
C.实验室可以用NaOH溶液处理SO2和NO2
D.Cl2具有很强的氧化性,在化学反应中只能做氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,某研究小组以氢氧化钠固体、浓氨水、干冰等为原料制备氨基甲酸铵的实验装置如图所示,其主要反应的原理为2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<O。
NH2COONH4(s) △H<O。
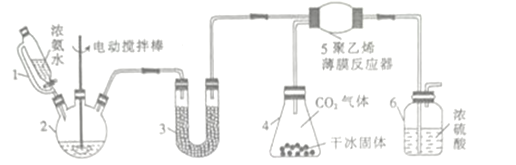
(1)仪器2的名称是________,仪器3中盛装的固体是_________,其作用是______________。
(2)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内浓硫酸中产生气泡,则应该______________(填“加快”“ 减慢”或“不改变”)产生氨气的速率。
(3)另一种制备氨基甲酸氨的反应装置(液体石蜡和CCl4均充当惰性介质)如图所示。
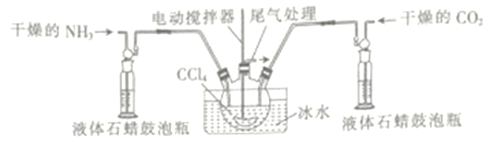
①液体石蜡鼓泡瓶的作用是_____________________ 。
②若无冰水,则氨基甲酸铁易分解生成尿素[CO(NH)2]2请写出氨基甲酸铵受热分解的化学方程式:_______________________。
③当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥,可采取的方法是_______________(填字母)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
(4)制得的氨基甲酸铵中可能含有碳酸氢铵、碳酸铵中的一种或两种杂质(不考虑氨基甲酸铵与水的反应)。
①设计方案进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解 | 得到无色溶液 |
步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,则证明固体中不含碳酸铵 |
步骤3:向试管中继续加入___________ | _____________________________, 则证明固体中含有碳酸氢铵 |
②根据①的结论,取15.8g氨基甲酸氨样品,用足量氢氧化钡溶液充分处理后,过滤洗涤、干燥测得沉淀质量为1.97g。则样品中氨基甲酸铵的质量分数为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分离的方法正确的是( )
A.从碘水中提取碘:用酒精萃取
B.除去CO中少量O2:通过灼热的Cu网后收集气体
C.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
D.除去CO2中的少量HCl:通入饱和NaHCO3溶液,收集气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com