
分析 浓硫酸增重21.6g为反应生成的水的质量,通过灼热氧化铜,由于发生反应CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,固体质量减轻了6.4g,结合方程式利用差量法可计算CO的物质的量,通过碱石灰时,碱石灰的质量增加了35.2g可计算总CO2的物质的量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据元素守恒计算有机物中含有C、H、O的物质的量,进而求得化学式;结合分子式、与钠反应生成氢气的体积,判断分子中官能团,据此书写结构简式.
解答 解:(1)有机物燃烧生成水21.6g,物质的量为:$\frac{21.6g}{18g/mol}$=1.2mol,
令有机物燃烧生成的CO为x,则:
CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 固体减少△m
28g 16g
x 6.4g
所以x=$\frac{28g×6.4g}{16g}$=11.2g,CO的物质的量为:$\frac{11.2g}{28g/mol}$=0.4mol,
根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.4mol,质量为0.4mol×44g/mol=17.6g,
有机物燃烧生成的CO2的质量为35.2g-17.6g=17.6g,其物质的量为:$\frac{17.6g}{44g/mol}$=0.4mol,
根据碳元素守恒可知,1mol有机物含有碳原子物质的量为:$\frac{0.4mol+0.4mol}{0.4}$=2mol,
根据氢元素守恒可知,1mol有机物含有氢原子物质的量为:$\frac{1.2mol×2}{0.4}$=6mol,
根据氧元素守恒可知,1mol有机物含有氧原子物质的量为:$\frac{1.2mol+0.4mol+0.4mol×2-0.8mol×2}{0.4}$=2mol,
所以有机物的分子式为:C2H6O2,
故答案为:C2H6O2;
(2)0.1mol该有机物恰好与4.6g金属钠完全反应,即与0.2mol钠反应,说明含有2个羟基,应为HOCH2CH2OH,故答案为:HOCH2CH2OH.
点评 本题考查了有机物分子式、结构简式的确定,侧重于学生的分析、计算能力的考查,题目难度中等,注意掌握常见有机物结构与性质,明确质量守恒定律在确定有机物分子式中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 在NaClO溶液中通入过量SO2气体:ClO-+H2O+SO2═HClO+HSO${\;}_{3}^{-}$ | |
| B. | 用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| C. | NaHCO3与少量的Ca(OH)2溶液反应:Ca2++2OH-+2HCO${\;}_{3}^{-}$═CaCO3↓+2H2O+CO${\;}_{3}^{2-}$ | |
| D. | 10mL 0.5mol/L的明矾溶液与20mL 0.5mol/L Ba(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO${\;}_{4}^{2-}$═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 符号 | 质子数 | 电子数 |
| 1 | 0 | |
| NH4+ | ||
| Mn- | b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )| A. | 充分燃烧等质量的X和甲烷,X消耗氧气较多 | |
| B. | X中碳原子在同一平面上 | |
| C. | X和乙烷类似,都容易发生取代反应 | |
| D. | X既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 经常接触铅笔芯易造成铅中毒 | |
| B. | 用漂粉精和洁厕灵的混合液清洗马桶效果更佳 | |
| C. | 新核素的发现意味着新元素的合成 | |
| D. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ②④ | C. | ③⑤ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碘水可以鉴别葡萄糖溶液和淀粉溶液 | |
| B. | 淀粉、油脂和蛋白质在一定条件下都能发生水解反应 | |
| C. | 分子式为C2H6和C5H12的两种有机物一定互为同系物 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
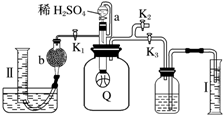 为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中.按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中.
为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中.按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com