
分析 该原电池中,锌电极上电极反应式为Zn-2e-=Zn2+,铜电极上电极反应式为2H++2e-=H2↑,则电池反应式为Zn+2H+=H2↑+Zn2+,
(1)根据氢气和锌之间的关系式计算锌的质量;
(2)根据氢气和转移电子之间的关系式计算转移电子的物质的量;
(3)根据氢原子守恒计算硫酸的浓度.
解答 解:该原电池中,锌电极上电极反应式为Zn-2e-=Zn2+,铜电极上电极反应式为2H++2e-=H2↑,则电池反应式为Zn+2H+=H2↑+Zn2+,
(1)设参加反应的Zn的质量为x,
Zn+2H+=H2↑+Zn2+
65g 22.4L
x 3.36L
$\frac{65g}{x}=\frac{22.4L}{3.36L}$解得:x=9.75g
答:消耗锌的质量9.75g;
(2)设转移电子的物质的量为y,
Zn+2H+=H2↑+Zn2+转移电子
22.4L 2mol
3.36L y
$\frac{22.4L}{3.36L}=\frac{2mol}{y}$
解得:y=0.30mol,
答:通过电子的物质的量为0.30mol;
(3)根据氢原子守恒得H2SO4~H2,则c(H2SO4)=$\frac{\frac{3.36L}{22.4L/mol}}{0.2L}$=0.75 mol•L-1,
答:原硫酸的浓度为0.75 mol•L-1.
点评 本题以原电池原理为载体考查了物质的量的有关计算,根据各个物理量之间的关系来分析解答,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
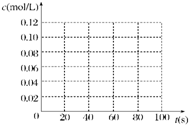 在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
在100℃时,将0.100mol 的四氧化二氮气体充入 1L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)(mol/L) | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)(mol/L) | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X的一种单质是自然界中硬度最大的物质 | |
| C. | 元素Y的单质只能与盐酸等酸反应生成氢气,而不能和碱反应 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中 | |
| B. | 容量瓶刚用蒸馏水洗净,没有烘干 | |
| C. | 定容时,加蒸馏水先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切 | |
| D. | 定容时仰视刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砷在通常情况下是固体 | B. | 砷的还原性比磷弱 | ||
| C. | As2O5对应水化物的酸性比H3PO4弱 | D. | 可以存在-3、+5等多种化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧元素的一种同位素 | B. | 氧元素的一种同素异形体 | ||
| C. | 一种新的氧化物 | D. | 由离子键构成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
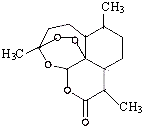 2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.已知青蒿素结构如图所示,则下列说法正确的是( )
2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.已知青蒿素结构如图所示,则下列说法正确的是( )| A. | 青蒿素与维生素C一样易溶于水 | |
| B. | 青蒿素的晶体为分子晶体,其化学式为C16H20O5 | |
| C. | 青蒿素不能与NaOH溶液反应 | |
| D. | 青蒿素分子有7个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com