
| A、1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| B、常温下,16gO2和O3的混合气体中含有的氧原子数为NA |
| C、标准状况下,22.4 L NO 和22.4 L O2混合后所得气体中分子总数为1.5 NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
| m |
| M |
| 16g |
| 16g/mol |


科目:高中化学 来源: 题型:
| A、pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A) |
| C、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂发生皂化反应能生成甘油 |
| B、蔗糖及其水解产物均能与新制氢氧化铜反应生成红色沉淀 |
| C、实验室可以使用CuSO4溶液除去乙炔中的H2S等杂质 |
| D、甲烷、苯、乙醇、乙酸和乙酸乙酯都可以发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
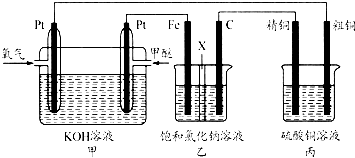
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 568 | 431 | 366 | 298 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它们均为酸性氧化物 |
| B、都溶于水,都能与强碱反应 |
| C、S元素和Si元素化合价都为+4价,因此从氧化还原角度考虑他们具有一样的性质 |
| D、SiO2可与HF反应,这是SiO2作为酸性氧化物的通性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙呈红色的溶液中K+、Na+、NO3-、S2O32- |
| B、NH4+、Fe3+、CO32-、CH3COO- |
| C、使酚酞变红色的溶液中:Na+、Cl-、K+、AlO2- |
| D、无色透明溶液中:SO32-、Cl-、K+、Cr2O72- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 体系pH | 不同温度下NaBH4的半衰期(min) | |||
| 0℃ | 25℃ | 50℃ | 75℃ | |
| 8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
| 10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
| 12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
| 14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度下,0.01 mol?L-1醋酸溶液的pH=4 |
| B、该温度下,用0.1 mol?L-1醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol?L-1的NaOH溶液,消耗两醋酸的体积比为1:10 |
| C、该温度下,0.2 mol?L-1醋酸溶液和0.4 mol?L-1醋酸钠溶液等体积混合后,混合液的pH<4.7 |
| D、该温度下,0.2 mol?L-1盐酸溶液和0.4 mol?L-1醋酸钠溶液等体积混合后,混合液的pH>4.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com