
【题目】甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH>0。
CO2(g)+3H2(g) ΔH>0。
(1)在一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示的该反应的速率为________。
(2)判断(1)中可逆反应达到平衡状态的依据是(填序号)________。
①v正(CH3OH)=v正(CO2) ②混合气体的密度不变 ③混合气体的平均相对分子质量不变
④CH3OH、H2O、CO2、H2的浓度都不再发生变化
(3)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为a L。试回答:
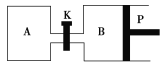
①反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH的转化率为________,A、B两容器中H2O(g)的体积百分含量的大小关系为B________A(填“>”“<”或“=”)。
②若打开K,一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
【答案】(1)0.01 mol/(L·s)(3分) (2)③④(2分) (3)①75%(3分) <(2分) ②1.75a(3分)
【解析】(1)设反应的CH3OH(g)的物质的量为x mol。
CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)
CO2(g)+3H2(g)
起始量(mol) 1 mol 3 mol
变化量(mol) x mol x mol x mol 3x mol
平衡量(mol) 1- x mol 3- x mol x mol 3x mol
混合气体的压强是反应前的1.2倍,则![]() ,x=0.4,则用甲醇表示的反应速率为
,x=0.4,则用甲醇表示的反应速率为![]() =0.01 mol/(L·s)。
=0.01 mol/(L·s)。
(2)题给反应中各物质都是气体,气体总质量始终不变,当容器体积不变时,密度不变。
(3)A为恒温恒容容器,B为恒温恒压容器,
① CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g)
CO2(g)+3H2(g)
起始/mol 1.2 2.4 0 0
转化/mol x x x 3x
平衡/mol 1.2x 2.4x x 3x
根据pV=nRT知,恒温恒压条件下,体积之比等于物质的量之比,![]() ,x=0.9,α(CH3OH)=
,x=0.9,α(CH3OH)= ![]() ×100%=75%。②打开K时,A、B组成一个恒温恒压容器,设平衡后B容器体积为V L,则有:
×100%=75%。②打开K时,A、B组成一个恒温恒压容器,设平衡后B容器体积为V L,则有:![]() =
=![]() ,V=1.75a。
,V=1.75a。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】根据热化学方程式:S(l)+O2(g)![]() SO2(g) ΔH=-293.23 kJ·mol-1 ,分析下列说法中正确的是
SO2(g) ΔH=-293.23 kJ·mol-1 ,分析下列说法中正确的是
A.S(s)+O2(g)![]() SO2(g),反应放出的热量大于293.23 kJ·mol-1
SO2(g),反应放出的热量大于293.23 kJ·mol-1
B.S(g)+O2(g)![]() SO2(g),反应放出的热量小于293.23 kJ·mol-1
SO2(g),反应放出的热量小于293.23 kJ·mol-1
C.1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和
D.1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家们欲寻找一种新型的半导体材料, 可以在元素周期表的
A. 任意位置寻找 B. 稀有气体元素中寻找
C. 金属和非金属的分界线处寻找 D. 活泼金属和活泼非金属区中寻找
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016·海南]油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g) ![]() 57CO2(g)+52H2O(l)已知燃烧1 kg该化合物释放出热量3.8×104 kJ。油酸甘油酯的燃烧热△H为
57CO2(g)+52H2O(l)已知燃烧1 kg该化合物释放出热量3.8×104 kJ。油酸甘油酯的燃烧热△H为
A.3.8×104 kJ·mol1 B.3.8×104 kJ·mol1
C.3.4×104 kJ·mol1 D.3.4×104 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液,①汽油和氯化钠溶液;②乙醇和CCl4溶液的混合物;③氯化钠和单质碘的水溶液,分离以上各混合物的正确方法依次是
A.分液、萃取、蒸馏B.萃取、蒸馏、分液
C.分液、蒸馏、萃取D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C2H4(g)和C2H5OH(l)的燃烧热分别是 1 411.0 kJ/mol和 1 366.8 kJ/mol,则由C2H4(g)与H2O(l)反应生成C2H5OH(l)的ΔH为
A.44.2 kJ/mol B.+44.2 kJ/mol
C.330 kJ/mol D.+330 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3晶体是一种常见的氧化剂,生产工艺如图所示:
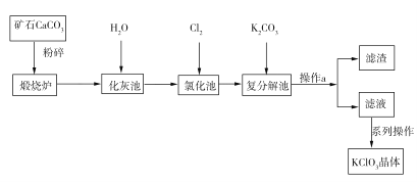
请回答下列问题:
(1)CaCO3煅烧前要粉碎的目的是____________________________。
(2)写出“氯化池”中生成Ca(ClO3)2的化学方程式:___________________________。该反应中,氧化剂与还原剂的物质的量之比为________。
(3)操作a中所需的玻璃仪器有漏斗、烧杯、__________。
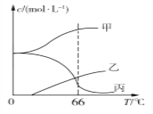
(4)实验室制取KClO3可通过反应:3Cl2+6KOH![]() 5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)
5KCl+KClO3+3H2O,在密闭容器中向9 ℃的KOH溶液中通入少量Cl2,此时Cl2的氧化产物主要是________________;继续通入适量Cl2,将溶液加热,溶液中主要离子的浓度随温度的变化如图所示,图中甲、乙、丙依次表示的离子是_________。(不考虑Cl2的挥发)
(5)甲同学为测定制取的KClO3样品中ClO3的含量,称取样品a g,准确配制成1000 mL溶液,从上述溶液中取出10.00 mL于锥形瓶中,准确加入30.00 mL 1.00 mol·L1 (NH4)2Fe(SO4)2溶液(过量)。再在锥形瓶中加入100 mL蒸馏水及某种氧化还原反应指示剂,用0.200 mol·L1 K2Cr2O7标准溶液滴定至终点,消耗5.00 mL。样品中ClO3的质量分数为______________。(已知:Cr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O,ClO3可被Fe2+还原为Cl。)
2Cr3++6Fe3++7H2O,ClO3可被Fe2+还原为Cl。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH标准溶液滴定盐酸,以下操作导致测定结果偏高的是
A. 滴定管用待装液润洗 B. 锥形瓶用待测液润洗
C. 滴定结束滴定管末端有气泡 D. 滴定时锥形瓶中有液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 molL-1min-1;乙:v(N2)=2 molL-1min-1;丙:v(NH3)=1 molL-1min-1.则三个容器中合成氨的反应速率
A.v(甲)>v(乙)>v(丙) B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙) D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com