
| 实验步骤 | 预期现象和结论 |
| 步骤一:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤二:在A试管中滴加 | 若 |
| 步骤三:在B试管中滴加 | 若 |
| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤一:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤二:在A试管中滴加 0.01mol?L-1KMnO4溶液,振荡. | 若 紫红色褪去,则说明假设1成立. |
| 步骤三:在B试管中滴加 紫色石蕊溶液,振荡 | 若 先变红后褪色,则说明假设2成立. |
| 0.224L |
| 22.4L/mol |
| n(NaOH) |
| n(CO2) |
| 3 |
| 2 |
|


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、足量碳酸氢钠溶液中滴加少量的石灰水:2HCO3-+Ca2++2 OH-═CaCO3↓+CO32-+2H2O |
| C、碳酸钙溶于稀醋酸:CO32-+2H+=H2O+CO2↑ |
| D、氯化钙溶液与CO2的反应:CO2+Ca2++H2O═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe(OH)3胶体 | CuSO4溶液 | ||
| A | 分散质粒子直径 | 大于100nm(10-7m) | 小于1nm(10-9m) |
| B | 外观 | 介稳体系,均一透明 | 稳定体系,均一透明 |
| C | 能否透过滤纸 | 可以 | 可以 |
| D | 激光笔照射 | 可看到光亮“通路” | 光可透过,但不形成光亮“通路” |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
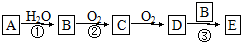
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
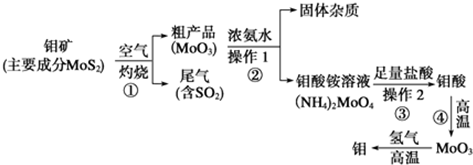
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 完全沉淀时的pH | 3.7 | 11.1 | 8(>9溶解) | 9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com