
| A、SO2有漂白性,所以能使品红溶液、溴水、KMnO4溶液褪色 |
| B、可将含有Ba(NO3)2的废液倒入水池中,再用水冲入下水道 |
| C、用玻璃试剂瓶盛装NaOH等强碱溶液时,不能盖上玻璃塞 |
| D、浓硫酸溅到皮肤上,要立即用大量的水冲洗,然后涂点稀氨水或涂点碳酸氢钠,最后再用水冲洗 |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
| A、纯碱溶液:NH4+、K+、NO3-、NH3?H2O |
| B、空气:C2H2、CO2、SO2、NO |
| C、氢氧化铁胶体:H+、K+、S2-、Br- |
| D、高锰酸钾溶液:H+、Na+、SO42-、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水与稀盐酸反应Ca(OH) 2+2H+=Ca2++2H2O |
| B、氢氧化钡与硫酸铜溶液混合:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu (OH) 2↓ |
| C、铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag |
| D、氯化铁溶液与氨水反应Fe3++3OH-=Fe (OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对于可逆反应,若改变条件使平衡右移,则到达新的平衡时的平衡常数K一定增大 |
| B、一定温度下,在a mol?L-1的饱和石灰水中加入适量的b mol?L-1 CaCl2溶液(b>a),则一定有Ca(OH)2析出 |
| C、相同温度时,CH3COOH的电离平衡常数Ka与NH3?H2O的电离平衡常数Kb相等,所以NH4HCO3的水溶液显碱性 |
| D、升高温度,以上常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4和HCN分子中,都含σ键和π键,但C原子的杂化方式并不相同 |
| B、在元素周期表中,p区元素的最外层电子排布均可表示为ns2np1~6 |
C、某基态原子的核外电子排布图为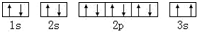 ,它违背了泡利不相容原理 ,它违背了泡利不相容原理 |
| D、用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol | ||
B、
| ||
C、
| ||
| D、5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| c(CH3OH)/mol?L-1 | 0.51 | 0.2 | 0.1 | 0.01 | 0.01 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com