
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | H+ | D. | S2- |
分析 任何电解质溶液中都呈电中性,溶液中阴阳离子所带电荷相等,根据阴阳离子所带电荷相等确定M所带电荷及浓度,据此分析解答.
解答 解:任何电解质溶液中都呈电中性,溶液中阴阳离子所带电荷相等,溶液中c(NO3-)+2c(SO42-)=2mol/L+2×1mol/L=4mol/L,c(H+)=2mol/L<c(NO3-)+2c(SO42-)=4mol/L,所以M带正电荷,根据表中数据知,c(M)=1mol/L,c(M)=c(NO3-)+2c(SO42-)-c(H+)=4mol/L-2mol/L=2mol/L,则M应该带2个单位正电荷,且不能和硫酸根离子和硝酸根离子反应,硫酸根和钡离子不能共存,
故选A.
点评 本题考查物质的量浓度计算,为高频考点,侧重考查学生分析判断及计算能力,明确电荷守恒、离子共存是解本题关键,易错选项是B.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 保持容器容积不变,向其中再加入1mol H2,反应速率加快,理由是增大反应物氢气的浓度,反应速率加快 | |
| B. | 保持容器内气体压强不变,向其中加入1mol N2(N2不参加反应),反应速率减慢,理由是保持压强不变,向其中充入N2,体积变大,反应物浓度减小,反应速率减慢 | |
| C. | 保持容器容积不变,向其中加入1mol N2(N2不参加反应),反应速率不变,理由是反应物的浓度不变,反应速率不变 | |
| D. | 保持容器内气体压强不变,向其中再加入1mol H2(g)和1mol I2(g),反应速率减小,理由是容器体积变大反应物浓度变小,反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molA+2molB | B. | 3molC+1molB+1molD+1molA | ||
| C. | 2molA+1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
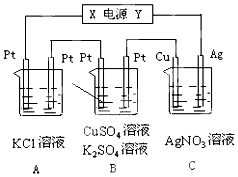 如图所示,溶液体积均为200mL,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,溶液体积均为200mL,若电解5min时铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| C. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 起相同作用 | B. | 起不同作用 | ||
| C. | 只起氧化剂的作用 | D. | 只起还原剂的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
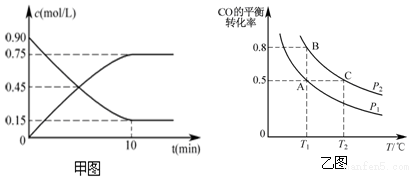
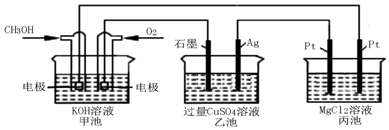
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com