
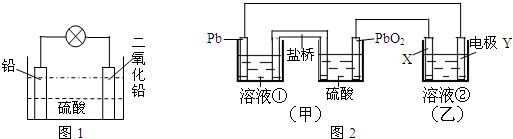
分析 (1)甲池中电解质溶液不能与Pb反应;原电池中阳离子向正极移动;
(2)根据已知式子中的反应物结合电荷守恒书写生成物;
(3)电解精炼时,粗铜作阳极,纯铜作阴极,电解质溶液为含有铜离子的溶液.
解答 解:(1)甲池中原电池的负极部分为Pb,甲池中电解质溶液①不能与Pb反应,所以甲中的溶液①可以是NaCl溶液等;原电池中阳离子向正极移动,PbO2为正极,则盐桥中的阳离子向盛硫酸的容器移动;
故答案为:NaCl;阳;
(2)铅蓄电池的正极反应是:PbO2+2e-+SO42-+4H+═PbSO4+2H2O.该电极反应可以通过如下三个式子进行分析,结合电荷守恒可知,
①PbO2+2e-=PbO+O2-;②PbO+2H++SO42-=PbSO4+H2O;③O2-+2H+=H2O;
故答案为:PbO+O2-;PbSO4+H2O;
(3)电解精炼时,粗铜作阳极,纯铜作阴极,电解质溶液为含有铜离子的溶液,Y与原电池的负极相连为阴极,阴极上铜离子得电子生成Cu,其电极反应为:Cu2++2e-=Cu;
故答案为:Cu2+;阴极;Cu2++2e-=Cu.
点评 本题考查了原电池原理和电解池原理的应用,注意把握电池正负极的判断和电极方程式的书写是解决本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | NH4++H2O?NH3•H2O+OH- | ||
| C. | PO43-+H2O?HPO42-+OH- | D. | H2O+H2O?H3O++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是单质 | B. | 一定是混合物 | ||
| C. | 可能是单质也可能是化合物 | D. | 可能单质是也可能是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA(注:粗铜含有Zn、Fe等杂质) | |
| B. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| C. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| D. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-) | B. | Kh(Na2S) | C. | $\frac{c({H}^{+})}{c({S}^{2-})}$ | D. | $\frac{c(N{a}^{+})}{c({S}^{2-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液中:NH4+、Ca2+、Cl-、K+ | |
| B. | Kw/c(OH-)=1.0mol•L-1的溶液中:Mg2+、NO3、NH4+、I- | |
| C. | 中性溶液中:K+、Cl-、Na+、CO32- | |
| D. | 无色溶液中:Fe3+、Cl-、Na+、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com