
【题目】已知标准状况下气体摩尔体积为22.4L/mol,但很多化学实验并非在标准状况下进行,而是在常温常压下进行,下图为测定常温常压下气体摩尔体积的实验装置图。图中反应原理为:2C2H5OH+2Na→2C2H5ONa+H2↑(反应放热)。

(1)①该装置有明显错误处,请指出错误之处:_________;
②作图修改(只针对需修改部位):_____________。
(2)经过(1)改正后进行实验,实验过程如下:
a.检查装置气密性;
b.常温常压下,取4.6g乙醇与足量的金属钠反应并利用排水法收集产生的H2(假设广口瓶和量筒足够大);
c.当圆底烧瓶中不再有气泡产生,不能立即读数,必须先_____,后________,再平视读取量筒中收集到水的体积为1240.0mL。经计算常温常压下气体摩尔体积为__________。
(3)经过(1)改正后仍有实验误差,下列哪些选项会导致实验误差_______。
A.收集到的氢气中含有装置中原有的空气
B.收集H2前导管B中无蒸馏水
C.分液漏斗中的无水乙醇进入圆底烧瓶后占用了装置内气体空间
【答案】 广口瓶中导管“短进长出” 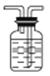 将气体恢复至室温 使广口瓶中液面于量筒中液面相平 24.8L/mol BC
将气体恢复至室温 使广口瓶中液面于量筒中液面相平 24.8L/mol BC
【解析】(1)①该装置有明显错误处,请指出错误之处:广口瓶中导管“短进长出”,②作图修改(只针对需修改部位):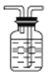 ,(2)气体的体积受温度和压强影响较大,当圆底烧瓶中不再有气泡产生,不能立即读数,必须先将气体恢复至室温,后使广口瓶中液面于量筒中液面相平,使广口瓶内压强等于大气压,由关系式:2CH3CH2OH~H2,4.6g乙醇与足量的金属钠反应收集到的H2应为
,(2)气体的体积受温度和压强影响较大,当圆底烧瓶中不再有气泡产生,不能立即读数,必须先将气体恢复至室温,后使广口瓶中液面于量筒中液面相平,使广口瓶内压强等于大气压,由关系式:2CH3CH2OH~H2,4.6g乙醇与足量的金属钠反应收集到的H2应为![]() =0.05mol,读取量筒中收集到水的体积为1240.0mL,经计算常温常压下气体摩尔体积为1240.0mL/0.05mol=1.240L/0.05mol= 24.8L/mol;(3)A、同温同压下气体的体积比等于气体的物质的量之比,收集到的氢气中含有装置中原有的空气,不影响增加的氢气体积的测量,故A错误;B、收集H2前导管B中无蒸馏水,使烧瓶内压强与大气压不等,会导致实验误差,故B正确;C、分液漏斗中的无水乙醇进入圆底烧瓶后占用了装置内气体空间,排出的气体当成了生成的H2的体积,会导致实验误差,故C正确。故选BC。
=0.05mol,读取量筒中收集到水的体积为1240.0mL,经计算常温常压下气体摩尔体积为1240.0mL/0.05mol=1.240L/0.05mol= 24.8L/mol;(3)A、同温同压下气体的体积比等于气体的物质的量之比,收集到的氢气中含有装置中原有的空气,不影响增加的氢气体积的测量,故A错误;B、收集H2前导管B中无蒸馏水,使烧瓶内压强与大气压不等,会导致实验误差,故B正确;C、分液漏斗中的无水乙醇进入圆底烧瓶后占用了装置内气体空间,排出的气体当成了生成的H2的体积,会导致实验误差,故C正确。故选BC。


科目:高中化学 来源: 题型:
【题目】下列反应或操作会明显产生吸热现象的是
A. 将氢氧化钠溶液迅速倒入盛有盐酸的量热计中 B. 浓硫酸加水稀释
C. 氯化铵固体和氢氧化钡固体在烧杯中混合搅拌 D. 甲烷的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,使NO2和O2按4:1体积比充满干燥烧瓶,将烧瓶倒置于水中,瓶内液面逐渐上升,假设烧瓶内溶液不扩散,则最终该溶液中溶质的物质的量浓度为( )
A. 1/14mol/L B. 4/5mol/L C. 1/28mol/L D. 1/42mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
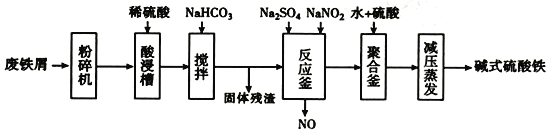
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型髙效絮凝剂,在医药上也可于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的流程如下:
已知:
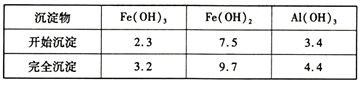
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)粉碎过筛的目的是____________________。
(2)加入少量NaHCO3的目的是________。
(3)反应釜中发生反应的离子方程式为_______________________。在实际生产中,常同时通入02以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于约NaNO2的物质的量为________。
(4)聚合釜中溶液的PH必须控制在一定的范围内。PH偏小时Fe3+水解程度弱,PH偏大时则_____________________________________。
(5)采取减压蒸发的原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CH3CH2OH是由-C2H5和-OH两种官能团组成的
B. CHFCl2分子结构只有一种
C. H2与D2互为同位素
D. 13C表示核内有6个质子,核外有7个电子的一种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72 L CH4 ②3.01×1023个HCl ③13.6 g H2S ④0.2 mol NH3,下列对四种气体的关系表示不正确的是
A. 体积④<①<③<② B. 密度①<④<③<②
C. 质量④<①<③<② D. 氢原子数④<②<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 漂白粉在潮湿空气中易变质
B. 光导纤维的主要成分是硅单质
C. 贮氢合金的发现和应用,开辟了解决氢气贮存、运输难题的新途径
D. 钢铁在潮湿空气里比在干燥空气里更易被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:

①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背_________,B元素位于周期表五个区域中的__________________区。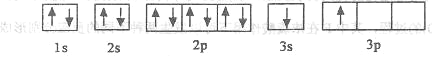
② ACl2分子中A的杂化类型为_________,ACl2的空间构型为_________。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为__________________。
②写出一种与CN—互为等电子体的单质的电子式____________。
③六氰合亚铁离子[Fe(CN)6]4—中不存在__________________。
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
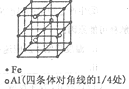
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
①确定该合金的化学式__________________。
②若晶体的密度=ρg/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com