
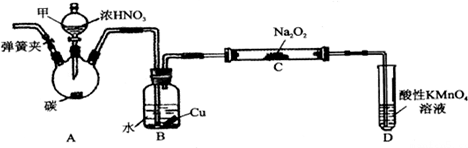
分析 A装置用于制备二氧化氮,二氧化氮进入B装置后和水反应生成NO和硝酸,硝酸和Cu反应生成NO,根据①2NO+Na2O2═2NaNO2知,NO和过氧化钠反应生成亚硝酸钠,根据②NO能被酸性高锰酸钾氧化成NO3-、而MnO4-被还原为Mn2+知,未反应的NO被酸性高锰酸钾溶液氧化生成NO3-,
(1)装置A中在加热条件下,C和浓硝酸发生氧化还原反应生成二氧化碳、二氧化氮和水;
(2)B装置中的水能和二氧化氮反应生成NO,且生成的硝酸也能和Cu反应生成NO;
(3)得到的NO气体中还含有二氧化碳气体,二氧化碳能和过氧化钠反应生成碳酸钠,所以为保证制得的亚硝酸钠的纯度,应该除去二氧化碳气体,二氧化碳气体是酸性气体,应该用碱性物质除去;
(4)NO有毒不能直接排空,可以用高锰酸钾溶液吸收;
(5)①将NaNO2滴加到酸性高锰酸钾溶液中,可观察到紫色溶液颜色变浅,直至褪色,说明二者发生氧化还原反应,亚硝酸根离子被氧化生成硝酸根离子,高锰酸根离子被还原生成锰离子;
②将SO2通入用稀盐酸酸化的NaNO2溶液中,二者发生氧化还原反应生成硫酸根离子,为证明有氧化还原反应发生,用盐酸酸化的氯化钡溶液检验硫酸根离子;
【问题讨论】
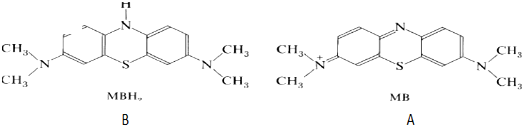
(6)比较AB结构知,B结构比A结构多H原子,则B为还原态.
解答 解:A装置用于制备二氧化氮,二氧化氮进入B装置后和水反应生成NO和硝酸,硝酸和Cu反应生成NO,根据①2NO+Na2O2═2NaNO2知,NO和过氧化钠反应生成亚硝酸钠,根据②NO能被酸性高锰酸钾氧化成NO3-、而MnO4-被还原为Mn2+知,未反应的NO被酸性高锰酸钾溶液氧化生成NO3-,
(1)装置A中在加热条件下,C和浓硝酸发生氧化还原反应生成二氧化碳、二氧化氮和水,反应方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)B装置的目的是①将NO2转化为NO、②铜与稀硝酸反应生成NO,故答案为:将NO2转化为NO;铜与稀硝酸反应生成NO;
(3)得到的NO气体中还含有二氧化碳气体,二氧化碳能和过氧化钠反应生成碳酸钠,所以为保证制得的亚硝酸钠的纯度,应该除去二氧化碳气体,二氧化碳气体是酸性气体,应该用碱性物质除去,故选BD;
(4)由信息可知,E装置的作用是吸收有毒的NO气体,避免污染空气,故答案为:吸收有毒的NO气体,避免污染空气;
(5)①将NaNO2滴加到酸性高锰酸钾溶液中,可观察到紫色溶液颜色变浅,直至褪色,说明二者发生氧化还原反应,亚硝酸根离子被氧化生成硝酸根离子,高锰酸根离子被还原生成锰离子,离子方程式为2MnO4-+5NO2-+6H+=2Mn 2++3H2O+5NO3-,
故答案为:2MnO4-+5NO2-+6H+=2Mn 2++3H2O+5NO3-;
②将SO2通入用稀盐酸酸化的NaNO2溶液中,二者发生氧化还原反应生成硫酸根离子,为证明有氧化还原反应发生,用盐酸酸化的氯化钡溶液检验硫酸根离子,其操作方法为:取少量试液于试管中,向试管内滴加盐酸酸化的氯化钡溶液,如果有白色沉淀生成就说明含有硫酸根离子,则二者发生氧化还原反应,
故答案为:取少量试液于试管中,向试管内滴加盐酸酸化的氯化钡溶液,如果有白色沉淀生成就说明含有硫酸根离子,则二者发生氧化还原反应;
(6)比较AB结构知,B结构比A结构多H原子,则B为还原态,故答案为:B.
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、实验装置的作用、氧化还原反应的应用为解答的关键,侧重分析与实验及应用能力的综合考查,题目难度中等.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
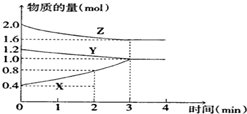 某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
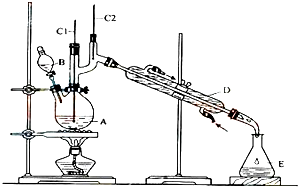 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少 | B. | 增大 | ||
| C. | 不变 | D. | 无法判断变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com