
| A. | Na+ | B. | Al3+ | C. | Fe2+ | D. | Fe3+ |
分析 过氧化钠和水反应生成氢氧化钠和氧气,过氧化钠具有强氧化性,亚铁离子具有还原性,氢氧化钠与FeCl3、FeCl2、AlCl3反应,最后产物再与过量的盐酸反应,以此解答该题.
解答 解:在含有FeCl3、FeCl2、AlCl3、NaCl的混合溶液中加入足量Na2O2固体,发生的反应有2Na2O2+2H2O=4NaOH+O2↑、Fe3++3OH-=Fe(OH)3↓、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3、Al3++4OH-=AlO2-+2H2O,充分作用后,再加入过量稀盐酸,发生的反应有Fe(OH)3+3H+=Fe3++3H2O、AlO2-+4H+=Al3++2H2O、OH-+H+=H2O,根据发生的反应知,Fe3+、Na+数目增多、Fe2+数目减少、Al3+数目不变,
故选B.
点评 本题考查钠的重要化合物,为高频考点,侧重考查学生的分析能力,明确物质的性质及物质之间发生的反应是解本题关键,注意亚铁离子的不稳定性,注意过氧化钠的性质,题目难度中等.


科目:高中化学 来源: 题型:实验题
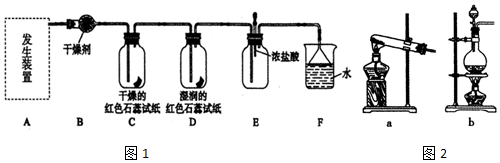
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


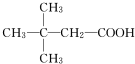 .(用结构简式表示)
.(用结构简式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释或对应的离子方程式 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 酸雨样品在空气中放置pH减小 | 亚硫酸被氧化为硫酸 2H2SO3+O2=2H2SO4 |
| C | “84”消毒液具有漂白性 | ClO-+CO2+H2O=HClO+HCO3- |
| D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体可以完全分解成为气体而除去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 丙烯 | C. | 乙炔 | D. | 丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 LCH3CH2OH中含有分子的数目为0.5NA | |
| B. | 58.5gNaCl晶体中含有NA个NaCl分子 | |
| C. | 56g铁粉与一定量氯化铁溶液反应生成0.75molFeCl2,失去的电子数为0.5 NA | |
| D. | 100mL浓度均为0.2mol/L的MgCl2和AlCl3混合溶液中阴离子的数目为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27 | B. | 5.4 | C. | 10.8 | D. | 16.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Br-、S2- | B. | Br-、Cl-、S2- | C. | S2-、Br-、Cl- | D. | Br-、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
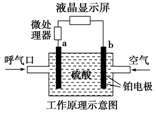 酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )
酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示.反应原理为:CH3CH2OH+O2═CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量.下列说法正确的是( )| A. | b为正极,电极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解质溶液中的H+移向a电极 | |
| C. | 若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 | |
| D. | 呼出气体中酒精含量越高,微处理器中通过的电流越小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com