
 某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.
某探究小组用酸性KMnO4溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:催化剂的用量可选择0.5g、0g,酸性KMnO4溶液的浓度可选择0.01mol•L-1、0.001mol•L-1,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL,H2C2O4溶液(0.1mol•L-1 )的用量均为2mL.| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
分析 (1)该反应中Mn元素化合价由+7价变为+2价,C元素化合价由+3价变为+4价(MnO4-→Mn2+,H2C2O4→CO2),根据转移电子守恒、原子守恒、电荷守恒写出离子方程式;
(2)根据实验的目的和影响化学反应速率的因素来设计实验;
(3)根据反应开始锰离子浓度较小,反应过程中锰离子浓度逐渐增大分析;选择含有锰离子的试剂进行验证;
(4)①根据酸性高锰酸钾溶液为紫红色,过程中不需要加指示剂;
②根据酸性高锰酸钾溶液具有强氧化性;
③在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,根据反应计算.
解答 解:(1)该反应中Mn元素化合价由+7价变为+2价,MnO4-→Mn2+,H2C2O4是弱酸,不能拆,其中C元素化合价由+3价变为+4价,H2C2O4→CO2,其转移电子总数为10,根据转移电子守恒知,MnO4-的计量数是2、H2C2O4的计量数是5,再根据电荷守恒、原子守恒得离子方程式为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O,
故答案为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O;
(2)由实验目的可知,探究浓度、温度、接触面积对化学反应速率的影响,则实验①②的温度、催化剂的用量相同,只有浓度不同;实验①③中只有温度不同,其他条件相同;实验①④中只有催化剂的用量不同,其他条件相同,故答案为:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | 298 | 0.5 | 0.001 | |
| ③ | 323 | 0.5 | 0.01 | |
| ④ | 298 | 0 | 0.01 |
点评 本题主要结合实验考查了外界条件对化学反应速率的影响,培养了学生分析问题、解决问题的能力,该题涉及氧化还原反应离子方程式的书写以及氧化还原滴定,虽然基于反应原理与中和滴定不同,但实验原理及操作和所用仪器等类似,由于该反应有明显的颜色变化,故可不用指示剂.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
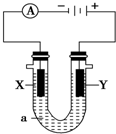 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:
某化学兴趣小组为了测定某草酸晶体的纯度及硫酸酸化的高锰酸钾溶液与草酸(H2C2O4)溶液反应的化学反应速率大小的影响因素,设计了如下实验.化学反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 固体成分(填化学式) |
| 1 | |
| 2 | |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯硝酸钾晶体 | B. | 大量硝酸钾晶体,少量氯化钠 | ||
| C. | 等量的硝酸钾和氯化钠 | D. | 大量氯化钠,少量硝酸钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com