
下列有关含铜化合物的说法错误的是(设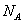 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
A.用盐酸可以洗去铜表面的铜锈
B. 0.1mol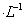 的CuSO4溶液中,Cu2+的数目一定小于0.1
的CuSO4溶液中,Cu2+的数目一定小于0.1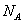
C.在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜
D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明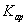 (CuS)远小于
(CuS)远小于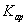 (FeS)
(FeS)
科目:高中化学 来源: 题型:
已知下列元素的半径为:
| 原子 | N | S | O | Si |
| 半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是( )
A.1.10×10-10m B.0.80×10-10m C.1.20×10-10m D.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生产、生活联系密切,下列说法正确的是
A.常用作净水剂的KAl(SO4)2和漂白粉都是强电解质
B.维生素C具有还原性,在人体内起抗氧化作用
C.对“地沟油”进行分馏可以获得汽油发动机的燃料
D.碘是人体必需的微量元素,所以要多吃富含高碘酸的食物
查看答案和解析>>
科目:高中化学 来源: 题型:
镓(Ga)、锗(Ge)、砷(As)、硒(Se)均为第四周期的元素,它们在高科技尖端
 科学特别是信息领域有着广泛的用途。试回答下列问题:
科学特别是信息领域有着广泛的用途。试回答下列问题:
(1)基态锗原子的价电子排布式为_________________________________。
(2)沸点:NH3________AsH3(填“>”、“<”或“=”,原因是______________
____________________________________________________________________.
(3)某砷的氧化物俗称“砒霜”,其分子结构如右图所示,该化合物的分子式
为_______________,As原子采取__________________杂化。
 (4) H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因_________________________________________________ 。
(4) H2SeO4和H2SeO3是硒的两种含氧酸,请根据结构与性质的关系,解释H2SeO4比H2SeO3酸性强的原因_________________________________________________ 。
(5)砷化镓可由(CH3)2Ga和AsH3在700℃下反应制得,反应的方程式
为_________________;砷化镓的晶胞结构如下图所示,其晶胞边长为a pm,
则每立方厘米该晶体中所含砷元素的质量为____________g(用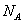 表示阿伏
表示阿伏
加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)请填写表中空格,完成由上述混合物得到固体甲的实验设计
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入98%H2SO4,充分搅拌直至固体不再溶解 |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 洗涤沉淀 | |
| ⑥ | 检验沉淀是否洗净 |
查看答案和解析>>
科目:高中化学 来源: 题型:
白藜芦醇广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性。能够跟1mol 该化合物起反应的Br2或H2的最大用量分别是( )
A.1mol 1mol B.3.5mol 7mol
C.3.5mol 6mol D.6mol 7mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com