
已知(HF)2 (g) 2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是
2HF(g) △H>0且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如右图所示。下列说法正确的是
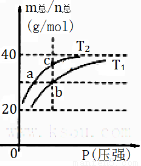
A.温度: T1<T2
B.平衡常数:K(b)<K(c)
C.反应速率:vb>va
D.当m总/n总 = 30g/mol时,n(HF):n[(HF)2]=2:1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届湖南长沙市三上学期第四次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的数值,下列叙述正确的是
A.在标况下,22.4LSO3和22.4LC2H4原子个数比为2:3
B.将78gNa2O2与过量CO2反应CO2转移的电子数为2NA
C.含0.2molH2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA
D.电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA
查看答案和解析>>
科目:高中化学 来源:2016届江西南昌第二中学高三上第三次考试理综化学试卷(解析版) 题型:实验题
氯离子插层镁铝水滑石[Mg2Al(OH)6Cl•xH2O]是一种新型离子交换材料。某课外活动小组同学利用如图甲装置(固定装置略去)测定[Mg2Al(OH)6Cl•xH2O]的化学式,[Mg2Al(OH)6Cl•XH2O]高温下分解为MgO、Al2O3、HCl和水蒸气。

(1)装置连接后首先进行的操作是______________________________。
(2)将一定质量的[Mg2Al(OH)6Cl•xH2O]放在加热装置中充分加热,冷却后称量剩余固体的质量是131g,则其中MgO的质量是_______g。
(3)若只通过测定装置C、D的增重来确定x,加热前先通过N2排尽装置中的空气,称取C、D的初始质量后,再持续通入N2 。
①装置的连接顺序为a→ (用接口处的小写字母表示)。
②实验过程中装置C吸收HCl气体,没有用如图乙所示防倒吸装置的理由是_______________。
③完全分解后测得C增重3.65g、D增重9.90g,则x=______。
(4)下列实验方案也能测定x值的是 ,并且对不选方案说明不合理的理由:__________(若两个方案都选,此问就不作答)。
方案1:测定加热装置剩余固体的质量和装置D增重的质量
方案2:测定加热装置剩余固体的质量和装置C增重的质量
(5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1-2x(CO3)y • zH2O],该生成物能发生类似的热分解反应。现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z,除测定D的增重外,至少还需测定下列数据中的 (填a、b、c等字母) 。
a.样品质量 b.样品分解后残余物质量 c.装置C的增重
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安第一中学高二上期中考试化学试卷(解析版) 题型:填空题
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。

(1)硫酸生产中,SO2催化氧化生成SO3 :
:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,
体系总压强为0.10MPa。该反应的平衡常数等于_______。
②若改在容器中加入1.0 mol SO2、0.5mol O2和amol SO3,保持温度不变反应达 平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。[
平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。[
③平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+C02(g) +2H20(g) △H=-574 kJ·mol-1
+2H20(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H20(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH 4还原NO2至N2整个过程中,放出的热量为______kJ。
4还原NO2至N2整个过程中,放出的热量为______kJ。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西忻州第一中学高一上期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.氯化钠溶液在电流作用下电离成钠离子和氯离子
B.溶于水后能电离出氢离子的化合物一定是酸
C.硫酸钡难溶于水,故硫酸钡不属于电解质
D.二氧化碳溶于水能导电,但二氧化碳不属于电解质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉华中师大一附中高一上期中化学卷(解析版) 题型:推断题
下图是中学化学中常见物质间的转化关系。其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体且1 mol E中含有 10 mol电子。乙和丁为黑色固体,将它们混和加热后发现固体由黑色变为红色。

(1)写出化学式:甲_________ ;乙________;丙_______;
(2)丁的摩尔质量为 。
(3)写出丙和E反应生成A和B的化学方程式: 。
(4)有学生将乙和丁混和加热后收集到标准状况下气体8.96 L ,测得该气体对氢气的相对密度为16,若将气体通入足量的澄清石灰水中,得到白色沉淀物 g。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉第二中学高二上期中考试化学试卷(解析版) 题型:推断题
下表是不同温度下水的离子积常数:
温度/℃ | 25 | T2 |
水的离子积常数 | 1×10-14 | 1×10-12 |
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是________________ ____。
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象____________________________________,其主要原因是(用离子方程式表示) 。
(4)已知25℃时:
难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解。当加碱调节pH为 时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果和原因是 。(lg2=0.3 lg3=0.48)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北衡水冀州中学高一上月考三理化学卷(解析版) 题型:选择题
下列条件下,两瓶气体所含原子数一定相等的是 ( )
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4和C3H8 D.同压强、同体积的N2O和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com