
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ______________。
(2)表中元素能形成两性氢氧化物的化学式___________,写出⑦元素的单质与⑨最高价氧化物的水化物反应的离子方程式 ______。
(3)④元素与⑦元素形成化合物的电子式 ___________。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是(填化学式)_____________。
(5)③元素与⑩元素两者核电荷数之差是 _________。
(6)水溶液中⑦的单质可以将⑩的简单离子置换为其单质,写出该反应的离子方程式_______。
【答案】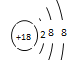 Al(OH)3 Cl2 + 2OH- = Cl- + ClO- + H2O
Al(OH)3 Cl2 + 2OH- = Cl- + ClO- + H2O 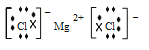 HClO4 26 Cl2 + 2Br- =2Cl- + Br2
HClO4 26 Cl2 + 2Br- =2Cl- + Br2
【解析】
根据元素在周期表中的位置知,①~⑩种元素分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br元素。结合元素周期律和物质的性质分析解答。
(1)这些元素中最不活泼的元素是Ar,其原子核外有18个电子,核外有3个电子层,其原子结构示意图为![]() ;
;
(2)表中能形成两性氢氧化物的元素是铝,形成两性氢氧化物的化学式为Al(OH)3;⑨最高价氧化物的水化物是KOH,⑦元素的单质Cl2和KOH溶液反应生成氯化钾、次氯酸钾和水,反应的离子方程式为Cl2 + 2OH-= Cl- + ClO- + H2O;
(3)④是Mg,⑦是Cl,两种元素形成的化合物MgCl2是离子化合物;Mg2+与Cl-通过离子键结合,电子式为![]() ;
;
(4)①、②、⑥、⑦四种元素分别是C、N、S、Cl,四种元素最高价氧化物对应的水化物的酸性最强的是HClO4;
(5)③元素与⑩元素两者核电荷数之差=35-9=26。
(6) 水溶液中⑦的单质Cl2可以将⑩的简单离子Br-置换为其单质Br2,反应的离子方程式为Cl2 + 2Br- =2Cl- + Br2。


科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
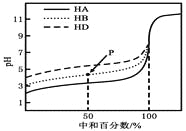
A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯(![]() )、苯乙烯(
)、苯乙烯(![]() )均是重要的有机溶剂和工业原料。
)均是重要的有机溶剂和工业原料。
已知:①![]() (g)+HCl(g)
(g)+HCl(g)![]()
![]() (g) △H1= 54 kJmol1
(g) △H1= 54 kJmol1
②H2(g)+Cl2(g)=2HCl(g) △H2=185 kJmol1
③![]() (g)+Cl2(g)
(g)+Cl2(g)![]()
![]() (g)+HCl(g) △H3=118kJmol1
(g)+HCl(g) △H3=118kJmol1
④相关化学键的键能数据如表所示:
化学键 | CH | CC | C=C | CCl | HCl |
键能/(kJmol1) | 412 | 348 | x | 341 | 432 |
请回答:
(1)x=___;
(2)![]() (g)+H2(g)
(g)+H2(g)![]() (g) △H4
(g) △H4
①△H4=___。
②上述反应中,![]() 的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
的平衡转化率α与温度(T)和压强(P)的关系如图所示。则:
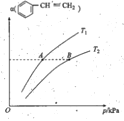
I.A、B两点的平衡常数:K(A)___K(B)(填“大于”、“小于”或“等于”)。
II.A、B两点的正反应速率:v(A)___v(B)(填“大于”、“小于”或“等于”)。
(3)工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)。向体积为VL的恒容容器中充入amol乙苯,压强为1×106Pa,在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①乙苯的平衡转化率为___;
②此温度下乙苯催化脱氢的方法制取苯乙烯的平衡常数Kp=___Pa;
③实际生产的反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比对乙苯转化率的影响可用图表示。[M=n(H2O)/n(乙苯]
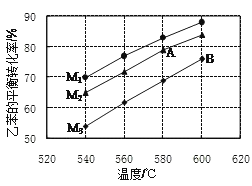
a.图中投料比(M1、M2、M3)的大小顺序为___;
b.随着反应的进行,催化剂上的少量积炭使其活性减弱,水蒸气有助于恢复催化剂的活性,原因是___(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的铁和下列酸反应,产生H2的物质的量最多的是( )
A.10mL 18.4mol/L H2SO4B.30mL 3mol/L盐酸
C.30mL 2mol/L H2SO4D.30mL 5mol/L HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物中,存在同分异构体的是( )
①CH3CH2CH2Br在碱性溶液中水解
②甲苯在催化剂作用下与Cl2发生苯环上的取代反应
③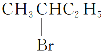 与NaOH的醇溶液共热反应
与NaOH的醇溶液共热反应
④![]() 在催化剂存在下与H2完全加成
在催化剂存在下与H2完全加成
A. ①②B. ①③
C. ③④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
A.该反应的平衡常数表达式K=![]()
B.达到平衡所需时间,甲与乙相等
C.平衡时NO2体积分数:甲<乙
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH溶液和5 mL 溴乙烷,振荡。
实验操作II:将试管如图固定后,水浴加热。
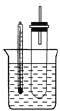
(1)用水浴加热而不直接用酒精灯加热的原因是_______________________。
(2)观察到__________________________现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)鉴定生成物中乙醇的结构,可用的波谱是___________________________________。
(4)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在你设计的实验方案中,需要检验的是__________,检验的方法是____________(需说明:所用的试剂、简单的实验操作及预测产生的实验现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
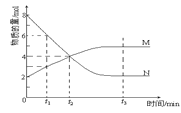
A.反应的化学方程式:2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:

(1)A的结构式为 ________________;C的结构简式为_________________;
(2)写出反应①的化学方程式_________________;
(3)反应③的反应类型为__________________;
(4)C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)______________;_______________。
(5)反应 ________(填序号)原子的理论利用率为100%,符合绿色化学的要求。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com