
��� | �� | �� | �� | �� |
ϡ�������/Ml | 100 | 200 | 300 | 400 |
ʣ�����/g | 18.0 | 9.6 | 0 | 0 |
NO���/mL | 2240 | 4480 | 6720 | V |
���м�������ȷ���ǣ� ��
A.�����Ũ��Ϊ4 mol��L-1 B.�����ܽ���5.6 g Fe
C.�����ܽ���9.6 g Cu D.����V=6720
A
������������Fe����HNO3��Ӧ������Fe(NO3)2,Ȼ��Cu��HNO3��Ӧ�����Fe2+��HNO3��������Ӧ�Ļ�ѧ����ʽ�ֱ�Ϊ��
3Fe+8HNO3====3Fe(NO3)2+2NO��+4H2O
3Cu+8HNO3====3Cu(NO3)2+2NO��+4H2O
3Fe(NO3)2+4HNO3====3Fe(NO3)3+NO��+2H2O
����HNO3��ȫ��Ӧ����8HNO3��2NO,��n(HNO3)=0.4 mol,c(HNO3)=4 mol��L-1,A����ȷ��
�ȽϢ���ڣ�������ڢٶ����100 mL HNO3,8.4 g�����ܽ⣬����NOΪ0.1 mol���ü��˼��跨���������ܽ��ȫΪFe����m(Fe)=8.4 g�����ܽ��ȫΪCu����m(Cu)=9.6 g�����ɢٵ����ܽ��8.4 gΪFe���ȽϢ���ۣ�ͬ�����Ƴ��ܽ��9.6 g����ΪCu,Fe��Ϊ16.8 g,CuΪ9.6 g����B��C����ܱȢ۶����Ӧ��3Fe(NO3)2+4HNO3====3Fe(NO3)3+NO��+2H2O,Fe(NO3)2�����ʵ���Ϊ0.3 mol,������NOΪ0.1 mol��V=8960,��D���ȷ��


 �ܿ�����ĩ��̾�ϵ�д�
�ܿ�����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������������ ���ͣ�038
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�038
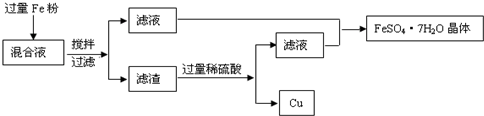
���ۺ�ͭ�۹�14.8g����������ۻ�Ͼ��ȣ�����ʹ֮��ȫ��Ӧ���õ�21.2g��ɫ���壬��ԭ������ĩ�����۵�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009-2010ѧ��㶫ʡտ�����и������ϣ��ڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com