
【题目】直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m (n>2,m≤10)的实验流程如下:

已知:盐基度=![]() ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是___________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2][Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c molL-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为a,则该试样的盐基度的计算表达式为________。
【答案】
(1)抑制Fe2+水解;确定氧化Fe2+所需H2O2的量;
(2)将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照; 偏低;(3)Fe2(SO4)3+nH2O![]() Fe2(OH)n(SO4)3-n/2+
Fe2(OH)n(SO4)3-n/2+![]() H2SO4;
H2SO4;
(4)①加入最后一滴NaOH标准液,烧杯中液体红色恰好褪去,且30s内不恢复;
②{[56(V0-V)c×10-3]/3ma}×100%。
【解析】
试题分析:(1)Fe2+易水解,实验加入硫酸的作用是防止亚铁离子水解.取样分析Fe2+浓度,是定量分析,其目的是确定氧化Fe2+所需H2O2的量,故答案为:抑制Fe2+水解,确定氧化Fe2+所需H2O2的量;
(2)依据pH试纸的操作方法分析:将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照.若溶液的pH偏小,说明Fe2+有部分水解了,将导致聚合硫酸铁中铁的质量分数偏低;故答案为:将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照; 偏低;
(3)温度对化学反应速率有影响,另外H2O2会受热分解.故氧化时控制反应温度为50~60℃的原因是温度过低,反应太慢;温度过高,H2O2分解加快,导致氧化剂用量增加;故答案为:温度过低,反应太慢;温度过高,H2O2分解加快,导致氧化剂用量增加;
(4)水解的原理是Fe2+结合水中的OH-,反应的方程式为:Fe2(SO4)3+nH2OFe2(OH)n(SO4) 3-n/2+![]() H2SO4;故答案为:Fe2(SO4)3+nH2OFe2(OH)n(SO4) 3-n/2+
H2SO4;故答案为:Fe2(SO4)3+nH2OFe2(OH)n(SO4) 3-n/2+![]() H2SO4;
H2SO4;
(5)①酚酞与碱会变红,故达到滴定终点的现象为:加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色;故答案为:加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色;
②已知:盐基度=![]() ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.通过化学式的计算,w=
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.通过化学式的计算,w=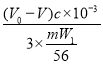 ×100%=
×100%=![]() ×100%;故答案为:
×100%;故答案为:![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 分液时,先将上层液体从上口倒出
B. 萃取时,振荡后,须打开活塞放气
C. 蒸馏时,先点燃酒精灯,后通冷凝水
D. 蒸发时,将溶剂蒸干一段时间后,熄灭酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.上层为无色,下层为紫红色
B.整个溶液变为棕黄色
C.整个溶液变紫色
D.下层无色,上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g)![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g)![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图:
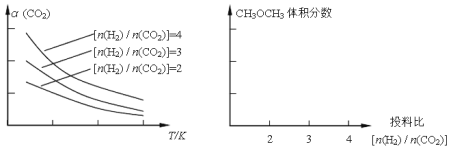
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是 。
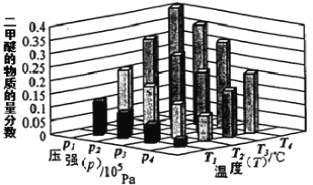
A. P3>P2,T3>T2 B. P1>P3,T1>T3
C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征是( )
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1nm~100nm之间
D.胶体在一定条件下能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法不正确的是
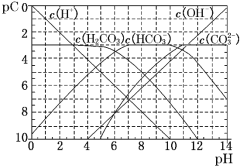
A.某温度下,CO2饱和溶液的浓度是0.05 molL-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和溶液中H2CO3的电离度约为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1 mol·L-1Na2CO3中c(HCO3﹣)比0.1 mol·L-1NaHCO3中c(HCO3﹣)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质特征是( )
A.分散质粒子直径在1nm~100nm之间
B.产生丁达尔现象
C.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
D.胶体在一定条件下能稳定存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com