
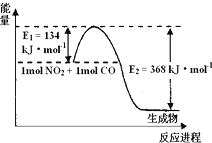
 氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(图中涉及物质为气态)| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
| c2(NH3) |
| c(N2)?c3(H2) |
| 22 |
| 4×63 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘受热变成碘蒸气是碘分子发生了变化 |
| B、参加化学反应的二氧化硫分子是不能再分的最小粒子 |
| C、物体受热膨胀,是由于分子受热后分子体积变大的缘故 |
| D、坐在教室里闻到窗外飘进来的桂花香气,说明分子在不停地运动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,0.2mol?L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法不正确的是( )
常温下,0.2mol?L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法不正确的是( )| A、HA为弱酸 |
| B、该混合液pH>7 |
| C、图中X表示HA,Y表示OH-,Z表示H+ |
| D、该混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
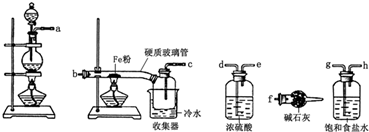
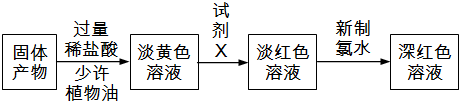
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑥ | B、①②③④ |
| C、④⑤⑥⑦ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
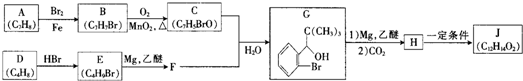

| 反应条件1 |
| 反应条件2 |
| (1)HCHO |
| (2)H2O |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素位于第5周期,ⅢB族 |
| B、该元素原子核外有5个电子层 |
| C、该元素原子最外层共有3个电子 |
| D、该元素原子M能层共有18个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com