
【题目】下列说法中正确的是( )
A.1 mol O2和1 mol N2所占的体积都约为22.4 L
B.H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N的物质的量约2 mol
【答案】D
【解析】解:A、标况下,1 mol O2和1 mol N2所占的体积都约为22.4 L,故A错误;
B、H2的气体摩尔体积约为22.4 L/mol,故B错误;
C、在标准状况下,1 mol H2所占的体积都约为22.4 L,但是水在该状态下不是气体,体积不是22.4L,故C错误;
D、根据n= ![]() 可知混合气体的物质的量n=
可知混合气体的物质的量n= ![]() =1mol,由于N2和N2O均有2个N原子,故1mol混合气体中含2mol氮原子,故D正确.
=1mol,由于N2和N2O均有2个N原子,故1mol混合气体中含2mol氮原子,故D正确.
故选D.
【考点精析】根据题目的已知条件,利用气体的摩尔体积的概念的相关知识可以得到问题的答案,需要掌握单位物质的量气体所占的体积叫做气体摩尔体积.用Vm表示,Vm=V÷n.常用单位L·molˉ1.


科目:高中化学 来源: 题型:
【题目】化学是一门具有创造性的科学。下列事实不能直接体现这一说法的是( )
A.青蒿素的发现与合成B.水力发电
C.新型复合材料的发明D.“21世纪的金属”——钛的冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时,两者消耗NaOH的物质的量( )
A.无法比较B.相同C.中和HCl的多D.中和CH3COOH的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一元银币有银白色的金属光泽,有的同学认为它是由铁制成的,便找磁铁来吸一下,这一过程属于科学探究中的( )
A. 实验 B. 假设 C. 观察 D. 做结论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能大量共存于同一溶液中的是( )
A. CO32-、H+、Na+、NO3- B. H+、Ag+、Cl-、SO42-
C. K+、Na+、OH-、NO3- D. Ba2+、Ca2+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为__________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_________。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于__________(填晶体类型)
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________cm。(用含ρ、NA的计算式表示)
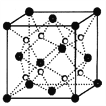
(3)下列说法正确的是__________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)图1是:Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

①图中d单质的晶体堆积方式类型是______________________。
②图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2 △H <0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2 △H <0。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v (N2) = ___________。
②假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是______。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
SO3(g)+NO(g)的ΔH=_____kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH_______0(填“>”或“ <”)。
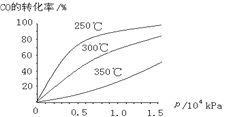
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为mol/L.
(2)若从中取出50mL,其物质的量浓度为mol/L;含溶质质量g.
(3)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为mol/L,SO42﹣的物质的量浓度为mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com