
 下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )| 实验目的 | 试剂 | 试管中的物质 | |
| A | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯②苯酚溶液 |
| B | 甲基对苯环的活性有影响 | 酸性KMnO4溶液 | ①苯②甲苯 |
| C | 苯分子中没有碳碳双键 | Br2的CCl2溶液 | ①苯②乙烯 |
| D | 碳酸的酸性比苯酚强 | 石蕊溶液 | ①苯酚溶液②碳酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯与溴水发生萃取,苯酚与溴水发生取代反应;
B.只有甲苯能被高锰酸钾氧化;
C.只有乙烯与溴发生加成;
D.苯酚酸性较弱,不能使指示剂变色.
解答 解:A.饱和溴水与苯进行萃取、与苯酚生成三溴苯酚沉淀,验证了羟基对苯环活性的影响,故A正确;
B.酸性高锰酸钾与甲苯反应生成苯甲酸,溶液褪色,验证苯环对甲基活性的影响,故B错误;
C.乙烯能使溴的四氯化碳溶液褪色,而苯不能,证明苯中无碳碳双键,故C正确;
D.碳酸能使石蕊变色,苯酚不能使石蕊变色,证明碳酸的酸性强于苯酚的酸性,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验现象与结论的关系为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 在氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3 | |
| B. | 在澄清石灰水中通入过量CO2:OH-+CO2=HCO3- | |
| C. | 在碳酸氢钙溶液中加入过量NaOH溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
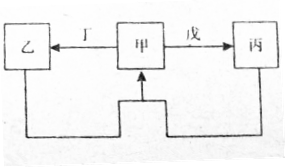
| A. | 假设:甲为Al(OH)3;结论:丁可能是盐酸 | |
| B. | 假设:甲为Na2CO3溶液;结论:戊可能是CO2 | |
| C. | 假设:甲为Fe;结论:丁可能是盐酸 | |
| D. | 假设:甲为N2;结论:戊可能是氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
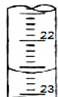 Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
Ⅰ:某学生用0.20mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
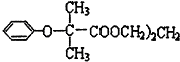 )可用于降低血液中的胆固醇,该物质合成线路如图所示:
)可用于降低血液中的胆固醇,该物质合成线路如图所示: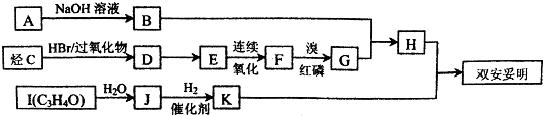
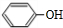
 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$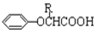
 ,J中所含官能团名称为醛基、羟基.
,J中所含官能团名称为醛基、羟基.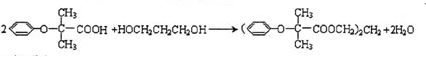 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
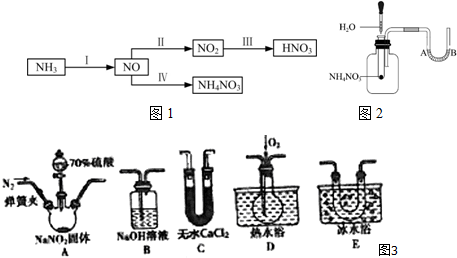
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
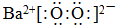 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com