
| A. | Na、Mg、Al元素最高化合价依次升高 | B. | P、S、Cl原子半径依次减小 | ||
| C. | N、O、F元素非金属性依次减弱 | D. | Li、Na、K原子的电子层数依次增多 |
分析 A、根据最外层电子数=最高化合价判断化合价;
B、根据同周期从左到右,元素的原子半径依次减小;
C、根据同周期从左到右,元素的非金属性逐渐增强;
D、根据同主族元素从上到下,电子层数逐渐增多.
解答 解:A、Na、Mg、Al最外层电子数分别为1、2、3,最高化合价分别为+1价、+2价、+3价,最高化合价依次升高,故A正确;
B、P、S、Cl元素在第三周期,且原子序数依次增大,同周期从左到右,元素的原子半径依次减小,则P、S、Cl原子半径依次减小,故B正确;
C、N、O、F元素在同一周期,原子序数依次增大,同周期从左到右,元素的非金属性逐渐增强,则N、O、F元素非金属性依次增强,故C错误;
D、Li、Na、K是同主族元素,从上到下,电子层数依次是2、3、4,逐渐增多,故D正确.
故选C.
点评 本题考查元素周期律知识,注意把握元素周期律的递变规律,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
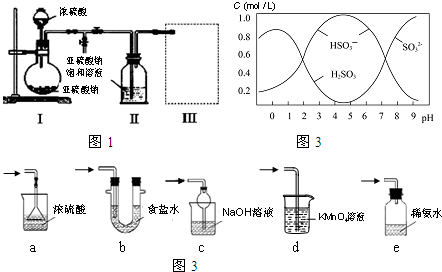
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、SO42-、K+ | B. | K+、OH-、CO32-、Na+ | ||
| C. | HCO3-、OH-、Cl-、Na+ | D. | Ag+、NO3-、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 LSO2含有的氧原子数均为1.5NA | |
| B. | 17g NH3中所含原子数为4NA | |
| C. | 23g Na在化学反应中失去的电子数目为NA | |
| D. | 标准状况下,分子数目为NA氯气所占的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .氧化剂为KClO3,浓盐酸的作用酸性、还原性.
.氧化剂为KClO3,浓盐酸的作用酸性、还原性.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
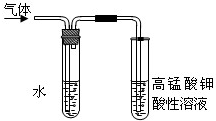 实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:
实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com