
| A. | 水污染的程度是由其溶氧量来测定 | |
| B. | 污染水的金属元素如汞、镉、铅等的含量极少时,不会对生物造成伤害 | |
| C. | 使用含磷洗衣粉会造成河水、湖水污染,使海藻疯狂生长,鱼类死亡 | |
| D. | 工业所排出的废水危害水生生物 |
分析 A.溶氧量是衡量水质的指标之一,但不能确定是否含有毒物质;
B.重金属离子能使生物会中毒;
C.含磷的生活污水可导致水中藻类植物大量生长;
D.工业废水含有毒物质或重金属离子等.
解答 解:A.溶氧量是衡量水质的指标之一,但不能确定是否含有毒物质,则水污染的程度不能单由其溶氧量说明,故A错误;
B.重金属离子能使生物会中毒,极少时不会对生物造成伤害,故B正确;
C.含磷的生活污水可导致水中藻类植物大量生长,则使用含磷洗衣粉会造成河水、湖水污染,使海藻疯狂生长,鱼类死亡,故C正确;
D.工业废水含有毒物质或重金属离子等,则不能排放到水中,会危害水生生物,故D正确;
故选A.
点评 本题考查三废处理及环境保护,为高频考点,把握常见的环境污染物及污染物的处理为解答的关键,侧重分析与应用能力的考查,注意化学与环境的联系,题目难度不大.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
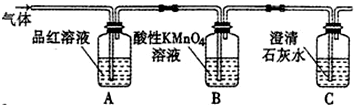
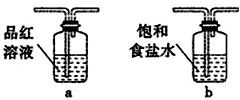
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 乙烯分子中,只有一个碳碳π键,四个碳氢σ键 | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐溶液为电镀液 | |
| D. | 甲醇分子内的O-C-H键角小于甲醛分子内O-C-H键角 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试剂 | 离子反应方程式 | |
| ①NaHCO3溶液(Na2CO3) | CO2 | CO2+H2O+CO32-=2HCO3- |
| ②Fe2O3(Al2O3) | NaOH溶液 | Al2O3+2OH-=2AlO2-+H2O |
| ③FeCl3溶液(FeCl2) | Cl2 | 2Fe2++Cl2=2Fe3++2Cl- |
| ④CO2(HCl) | 饱和的NaHCO3溶液 | HCO3-+H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
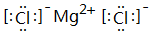 ,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.
,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.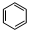 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$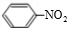 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
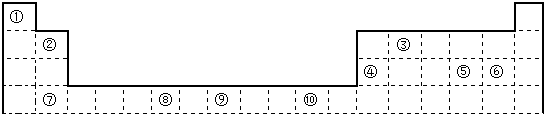
 .
. ;⑥和⑦形成的化合物电子式为
;⑥和⑦形成的化合物电子式为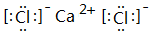 .③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.
.③和⑥形成的化合物晶体类型为分子晶体.元素①的4个原子与元素③的2个原子形成的分子中含有σ键的数目为5,π键数目为1.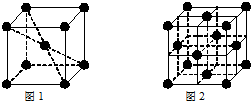
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
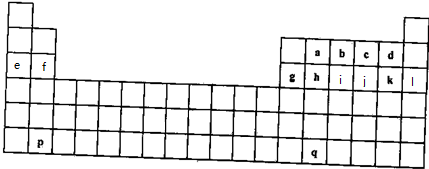
 ;用E的氧化物和氯化物都能干燥的气体有d
;用E的氧化物和氯化物都能干燥的气体有d查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com