
钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
下列说法正确的是 ( )
A.反应①不是氧化还原反应
B.该生产过程不产生任何污染
C.整个反应过程中,每有5.6gFe参加反应转移0.8mol电子
D.反应②中的氧化剂是NaNO2
科目:高中化学 来源: 题型:阅读理解
 (2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.
(2011?惠州模拟)铁、铜都是人类最早使用的金属,它们的单质及化合物应用非常广泛.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省安溪一中高一下学期期末联考化学试卷(带解析) 题型:实验题
(14分)某研究小组对铁生锈进行研究: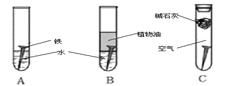
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母);
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为: ;
(3)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(4)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: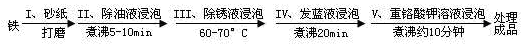
为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年云南省玉溪一中高一下学期期末考试化学试卷(带解析) 题型:实验题
(14分)某研究小组对铁生锈进行研究: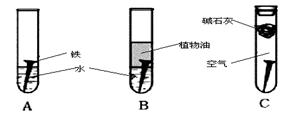
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母),铁锈的主要成分是
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
(3)铁生锈的外部条件是 ;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: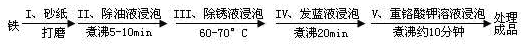
①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2 B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH D. 不需加入任何物质而直接使用
查看答案和解析>>
科目:高中化学 来源:2014届云南省高一下学期期末考试化学试卷(解析版) 题型:实验题
(14分) 某研究小组对铁生锈进行研究:
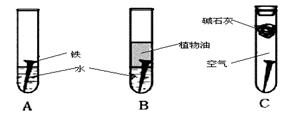
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母),铁锈的主要成分是
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
(3)铁生锈的外部条件是 ;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A. 锡 B. 铜 C. 锌
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:
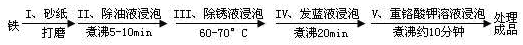
① 步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
② 为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③ 除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2 B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH D. 不需加入任何物质而直接使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com