
| A、Tl+的最外层有1个电子 |
| B、Tl+的还原性比Ag强 |
| C、Tl(OH)3为两性氢氧化物 |
| D、Tl3+的氧化性比Al3+弱 |


科目:高中化学 来源: 题型:
| A、它是一种可再生能源 |
| B、粮食作物是制乙醇的重要原料 |
| C、乙醇易燃烧,污染小 |
| D、乙醇只能在实验室内作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
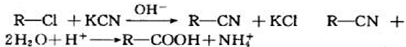

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用质谱法 |
| B、利用金属钠 |
| C、利用红外光谱法 |
| D、利用核磁共振氢谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉的有效成分是次氯酸钙 |
| B、实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收 |
| C、钠、铁和铜一样都能在氯气中燃烧生成金属氯化物 |
| D、干燥的氯气可以使有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是
)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(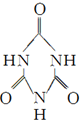 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过查看答案和解析>>
科目:高中化学 来源: 题型:
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol?L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com